Nervenzellen kommunizieren mit Hilfe elektrischer Signale. Ihre Ausläufer sind dazu von einer Art Isolierschicht umgeben, einer fettähnlichen Substanz namens Myelin. Sie verhindert Kurzschlüsse und beschleunigt zusätzlich erheblich die Erregungs-Weiterleitung. Bei Multipler Sklerose (MS) zerstört das körpereigene Immunsystem diese Myelinschicht. Folge sind neurologische Störungen, etwa beim Sprechen, Sehen oder Gehen.
Bislang versuchen Mediziner daher, das Immunsystem zu bremsen und so an seiner zerstörerischen Arbeit zu hindern. „Wir beschreiten dagegen in unserer Studie einen anderen Weg“, erklärt Prof. Dr. Evi Kostenis vom Institut für Pharmazeutische Biologie der Universität Bonn. „Wir wollen die geschädigte Myelinhülle um die Nervenfasern reparieren.“
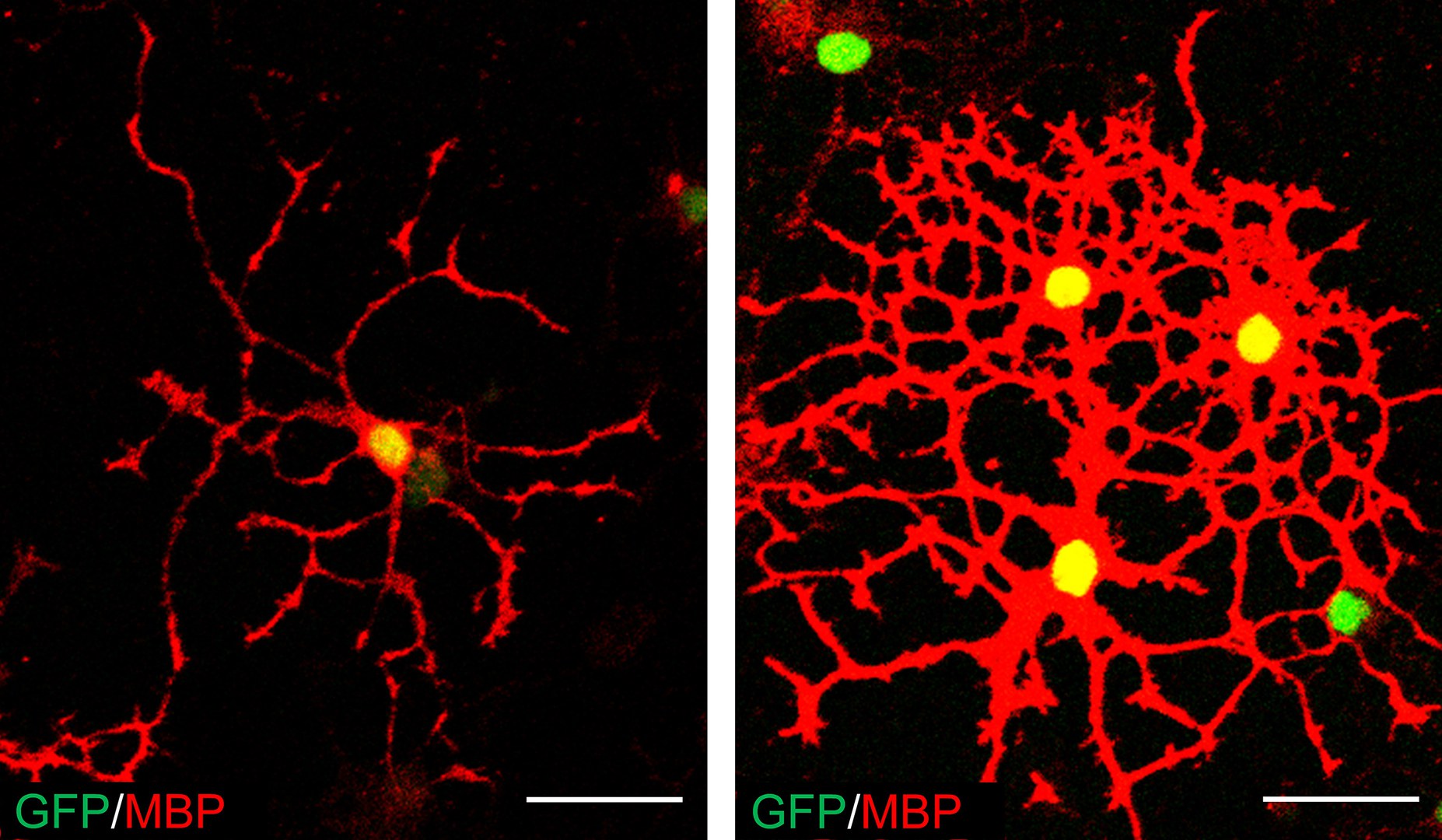
Die Forscher möchten dazu bestimmte Zellen im Gehirn nutzen, die Oligodendrozyten. Diese ähneln einem mikroskopisch kleinen Kraken: Von ihrem Zellkörper gehen sehr viele lange Ärmchen aus, die größtenteils aus Myelin bestehen. Wie ein Isolierband wickeln sich diese bei der Entwicklung des Gehirns um die Nervenzell-Fortsätze. Normalerweise hält die schützende Schicht ein Leben lang.
„Verwaister“ Rezeptor als Hoffnungsträger
Für Reparaturarbeiten gibt es im Gehirn zudem ein Reservoir unreifer Oligodendrozyten. Bei einem Schaden reifen sie heran und flicken das Loch in der Myelinhülle. Bei der Multiplen Sklerose ist dieser Mechanismus jedoch gestört: Viele der zellulären Isolierband-Spender verbleiben in ihrem unreifen Zustand. „Vor einigen Jahren haben wir jedoch entdeckt, dass sich der Reifungsprozess gezielt anschalten lässt“, erklärt Kostenis.
Eine Schlüsselrolle spielt bei diesem Prozess der so genannte GPR17-Rezeptor. Rezeptoren sind Moleküle, an die bestimmte Botenstoffe andocken können. Als Konsequenz ändert sich dann das Verhalten der Zelle, die den Rezeptor auf ihrer Oberfläche trägt. Allerdings ist GPR17 ein so genannter „verwaister“ Rezeptor: Es ist noch nicht bekannt, was seine körpereigenen Botenstoffe sind. Lange Zeit wusste man daher nicht, wofür er überhaupt zuständig ist.
Vor knapp zehn Jahren konnte die an der Studie beteiligte Arbeitsgruppe aus Cincinnati jedoch zeigen, dass GPR17 die Heranreifung von Oligodendrozyten steuert. „Uns ist es dann 2013 erstmals gelungen, den Rezeptor gezielt mit einem Wirkstoff zu aktivieren beziehungsweise zu hemmen“, sagt Kostenis. „Dabei konnten wir zeigen, dass der von uns genutzte Hemmstoff die Reifung der Oligodendrozyten fördert – leider aber nur in Ratten und Mäusen, wie wir inzwischen wissen.“
Die Wissenschaftler fahndeten daher in Datenbanken nach Substanzen, von denen bekannt ist, dass sie an Verwandte des GPR17-Rezeptors andocken können. Dann untersuchten sie jeden dieser Kandidaten auf seine Wirkung auf GPR17. Mit Erfolg: Eine der Testsubstanzen – ein Medikament namens HAMI – war dazu in der Lage, den GPR17-Rezeptor zu blockieren. Und zwar nicht nur in Zellkulturen von Maus und Ratte, sondern auch in solchen des Menschen. „Möglicherweise eignet sich HAMI also als Ausgangspunkt für neue MS-Medikamente“, hofft Kostenis.
Hami bewirkte in den getesteten Kulturen, dass die Oligodendrozyten ausreiften und dabei ihre charakteristischen Myelin-Ärmchen bildeten. Allerdings ist damit noch nicht gezeigt, dass die Substanz im Gehirn lebender Organismen die Myelinhülle wiederherstellen kann. „Wir sind jedoch angesichts unserer Experimente vorsichtig optimistisch“, sagt die Wissenschaftlerin der Universität Bonn. „Entsprechende Studien werden aber noch Jahre in Anspruch nehmen.“
Als Vorteil könnte sich herausstellen, dass HAMI schon als Wirkstoff gegen bestimmte Herzerkrankungen in präklinischer Entwicklung war. Damit hat er bereits etliche Hürden genommen, die neue Medikamente vor ihrer Testung am Menschen überwinden müssen.
Publikation: Nicole Merten, Julia Fischer, Katharina Simon, Liguo Zhang, Ralf Schröder, Lucas Peters, Anne-Gaelle Letombe, Stephanie Hennen, Ramona Schrage, Theresa Bödefeld, Celine Vermeiren, Michel Gillard, Klaus Mohr, Qing Richard Lu, Oliver Brüstle, Jesus Gomeza und Evi Kostenis: Repurposing HAMI3379 to Block GPR17 and Promote Rodent and Human Oligodendrocyte Differentiation. Cell Chemical Biology, DOI: 10.1016/j.chembiol.2018.03.012
Kontakt:
Prof. Dr. Evi Kostenis
Institut für Pharmazeutische Biologie
Universität Bonn
Tel.: 0228/73-2678
E-Mail: kostenis@uni-bonn.de