Die Krebstherapie wurde in der vergangenen Dekade durch die neuen Methoden der Immuntherapie revolutioniert. Dabei wird ein Tumor nicht direkt angegriffen, sondern die vorhandenen Zellen des Immunsystems genutzt. Diese sind eigentlich in der Lage, entartete Tumorzellen zu erkennen und zu beseitigen. Viele Tumore haben jedoch die Fähigkeit, eine effektive Immunantwort zu verhindern oder stark einzuschränken. Die Immuntherapie hat zum Ziel, das fehlgeleitete Immunsystem wieder in die Lage zu versetzen, die Tumorzellen zu erkennen und zu vernichten.
Die Rolle des Tumormikromilieus
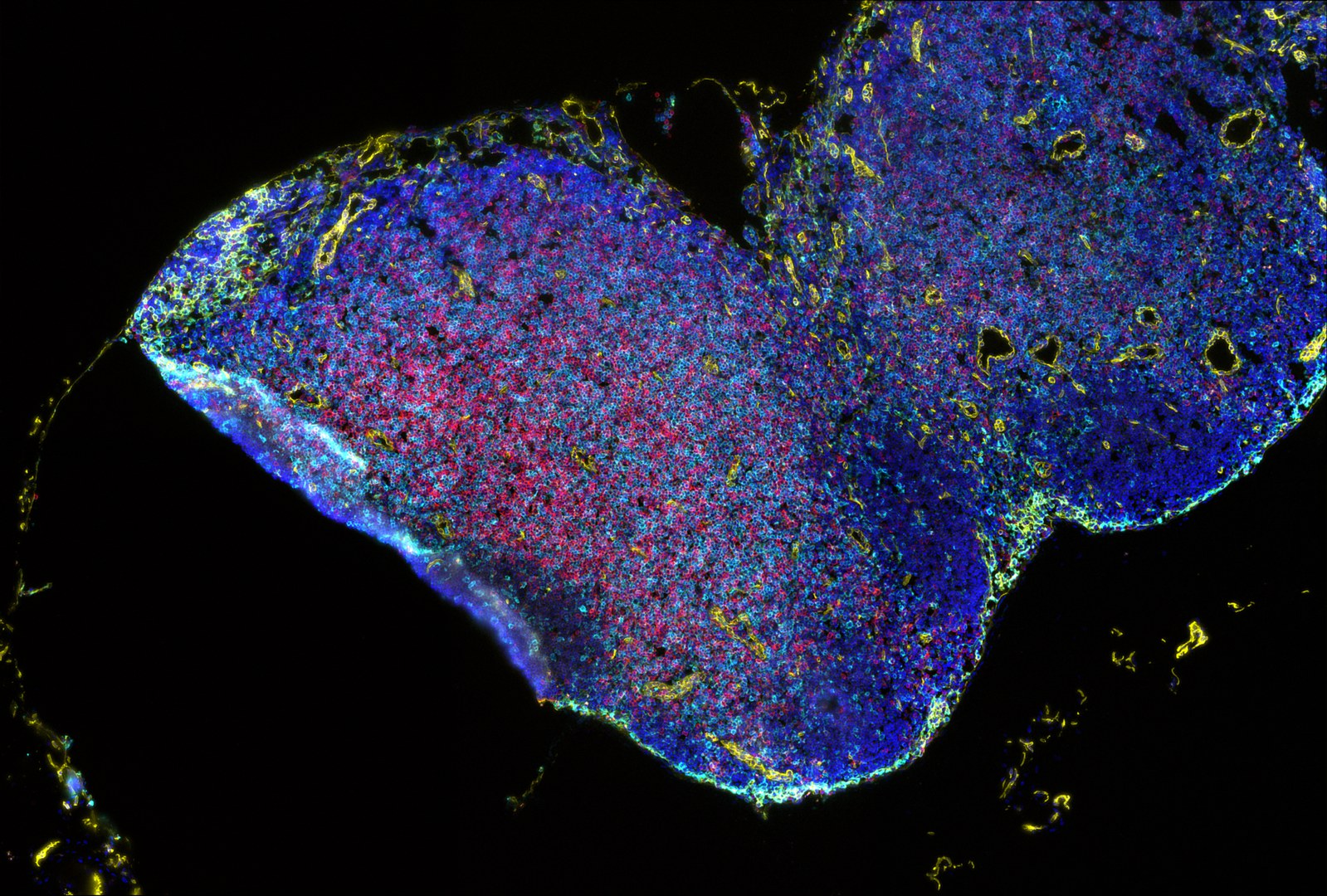
Eine Immuntherapie gegen Krebs ist nicht bei allen Patientinnen und Patienten erfolgversprechend. Es hat sich gezeigt, dass Resistenzen gegen Krebsimmuntherapien häufig mit der Zusammensetzung des Tumormikromilieus (TME) in Verbindung stehen. In der Onkologie werden die Eigenschaften des TME bereits heute als Biomarker genutzt, um Prognosen zur Entwicklung einer Krebserkrankung treffen zu können. Dazu verwendet man bildgebende Verfahren, die die Art und Lage der einzelnen Zellen innerhalb des TME abbilden. Es entstehen Muster gigantischer Zellverbände, die in ihrer Gesamtheit und Struktur Einfluss auf den Erfolg oder Misserfolg einer Krebsimmuntherapie nehmen. Wie genau das funktioniert, bleibt jedoch schwer zu fassen.
“Neue hochauflösende Bildgebungstechniken haben gezeigt, dass Krankheitsmechanismen tatsächlich mit Details der räumlichen Anordnung von bestimmten Zelltypen im Gewebe zusammenhängen”, sagt Prof. Kevin Thurley vom Institut für Experimentelle Onkologie, der die Arbeitsgruppe „Systems Biology of Inflammation“ der interdisziplinären Forschungseinheit „Mathematics and Life Sciences“ der Exzellenzcluster ImmunoSensation2 und Hausdorff Center for Mathematics (HCM) leitet. „Mit einer Kombination aus Methoden der mathematischen Modellierung und der Künstlichen Intelligenz werden wir diese Phänomene genau untersuchen, in direkter Zusammenarbeit mit experimenteller und klinischer Forschung am UKB.”
Künstliche Intelligenz zur Analyse von Geweben
Die auf Künstlicher Intelligenz (KI) basierenden Methoden zur Bildanalyse sind heute bereits weit fortgeschritten. Anders sieht es bei der Simulation komplexer Systeme aus – angesichts vieler miteinander interagierender Zellen innerhalb eines Gewebes. Wegen der großen Anzahl beteiligter Zelltypen, der dort ablaufenden unterschiedlichen zellulären Prozesse und der komplexen Gewebsarchitektur ist eine solche Simulation äußerst rechenintensiv. Sie kann jedoch helfen, das TME eines Tumors zu simulieren und so Rückschlüsse auf die Tumorentwicklung zu ziehen.
Erkenntnisse zur Immuntherapie durch maschinelles Lernen
Das übergeordnete Ziel von „InterpretTME“ ist die Entwicklung interpretierbarer Methoden des maschinellen Lernens (ML) für die Untersuchung komplexer Zellsysteme. Diese sollen genutzt werden, um Erkenntnisse zur Beschaffenheit von TMEs zu gewinnen. “Maschinelle Lernverfahren werden in der Klinik bereits an vielen Stellen verwendet, um Bilddaten zu verarbeiten“, erklärt Prof. Jan Hasenauer, vom Life & Medical Sciences-Institut (LIMES) der Universität Bonn. „Wir werden einen Schritt weiter gehen und untersuchen, wieweit auch Informationen über Mechanismen erlangt werden können.” Zum einen soll erforscht werden, welche Rolle einzelne im TME vorhandenen Immunzelltypen für die Entwicklung unterschiedlicher Tumortypen spielen. Darüber hinaus wollen die Forschenden ermitteln, welchen Effekt Chemotherapeutika und biologische Medikamente auf das TME unterschiedlicher Tumorarten haben. An dem Projekt wirken auch Prof. Michael Hölzel und Prof. Marieta Toma vom Universitätsklinikum Bonn und Prof. Alexander Effland von der Universität Bonn mit.