Krankmachende Bakterien der Gattung Salmonella oder Yersinia sind in der Lage, mit winzigen Schussapparaten schädigende Proteine gezielt in Wirtszellen zu injizieren - zum Leidwesen der Infizierten. Der Injektionsmechanismus dieser sogenannten Typ III-Sekretions-Systeme, kurz auch „Injektisome“, wird jedoch nicht nur im Hinblick auf die Krankheitsbekämpfung erforscht. Wären Bau und Funktion des Injektisoms genau bekannt, könnte man es kapern, um gezielt bestimmte Wirkstoffe in Zellen – zum Beispiel Krebszellen – einzuschleusen. Tatsächlich konnte die Struktur der Injektisome mittlerweile aufgeklärt werden. Unklar blieb jedoch bislang, wie die Bakterien ihre Spritzen beladen, damit die richtigen Proteine zum richtigen Zeitpunkt injiziert werden.
Einem Forschungsteam unter der Leitung von Dr. Andreas Diepold vom Max Planck-Institut in Marburg und Prof. Dr. Ulrike Endesfelder vom Institut für Mikrobiologie und Biotechnologie der Universität Bonn ist es nun gelungen, Antworten auf diese Frage zu finden: Mobile Bestandteile des Injektisoms durchkämmen die Bakterienzelle auf der Suche nach den Proteinen, die injiziert werden sollen, sogenannten Effektoren. Treffen sie auf einen Effektor, liefern sie diesen wie ein Shuttle-Bus an der Pforte der Injektionsnadel ab. „Wie Proteine der Sortierplattform im Zytosol an Effektoren binden und die Ladung zum Export-Gate des membrangebundenen Injektisoms liefern, erinnert an die Abläufe an einem Fracht-Terminal“, erklärt Dr. Stephan Wimmi, Postdoktorand in Andreas Diepolds Labor und einer der Erstautoren der Studie. „Wir denken, dass dieser Shuttle-Mechanismus dazu beiträgt, die Injektion effizient und spezifisch zugleich zu machen – schließlich müssen die Bakterien schnell die korrekten Proteine injizieren, um nicht beispielsweise vom Immunsystem erkannt und eliminiert zu werden.“
Für diesen Einblick in den wichtigen Lademechanismus des Injektisoms mussten die Forschenden neue Techniken anwenden. „Herkömmliche Methoden, mit denen man normalerweise nachweist, dass Proteine einander binden, haben für diese Frage nicht funktioniert – möglicherweise, weil die Effektoren nur kurz gebunden und dann direkt injiziert werden“, erklärt Andreas Diepold, Forschungsgruppenleiter am Max-Planck-Institut. „Deshalb mussten wir diese Bindung vor Ort und Stelle in den lebenden Bakterien untersuchen.“
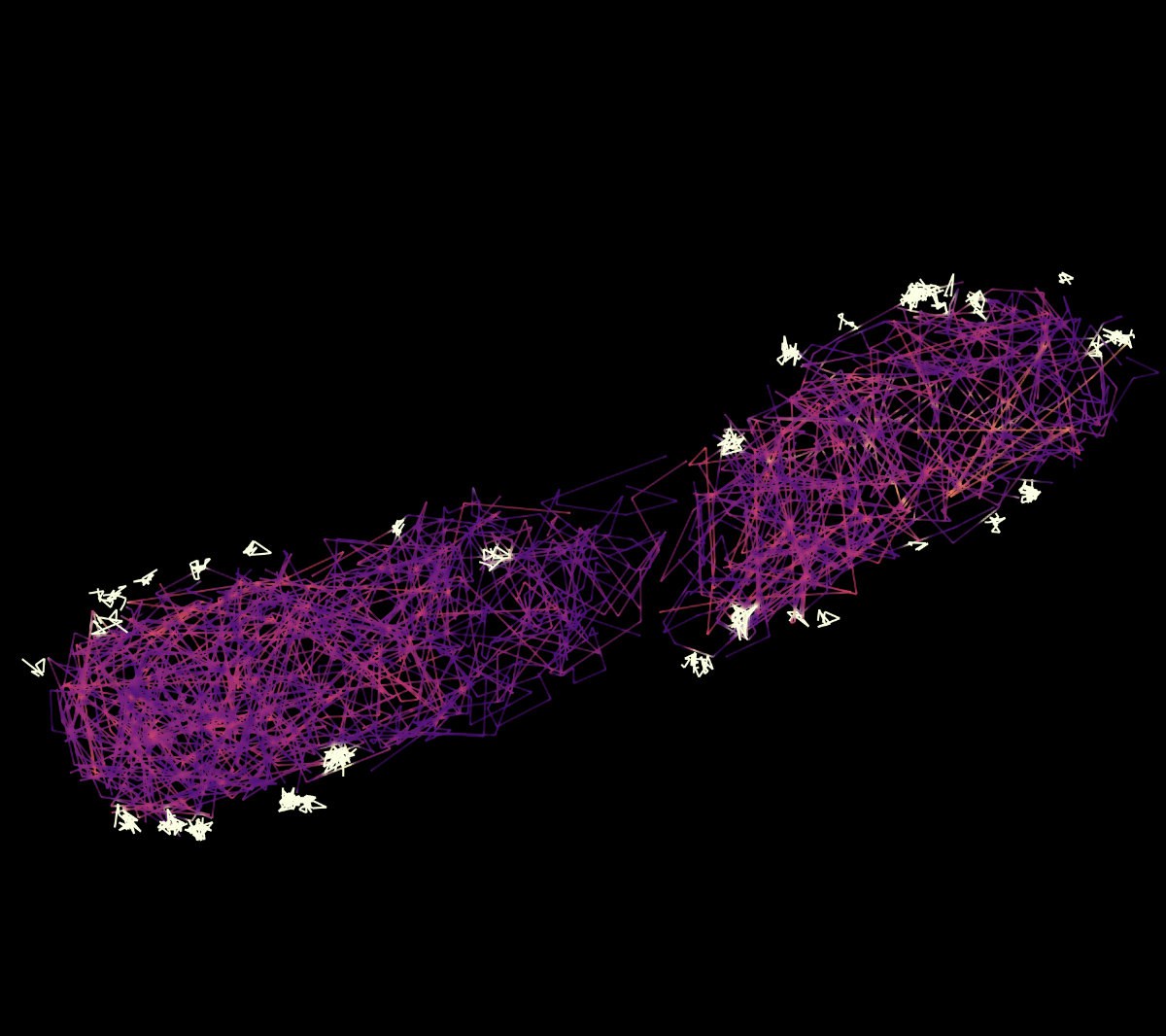
„Zur Analyse der Interaktionen nutzten wir zwei neuartige Ansätze, die in lebenden Zellen funktionieren, proximity labeling und single particle tracking“, fügt Ulrike Endesfelder hinzu, die auch Mitglied in den Transdisziplinären Forschungsbereichen „Modeling“ und „Life and Health“ der Universität Bonn ist. Ihre Forschungsgruppe arbeitete von drei Orten aus an dem Projekt: in Marburg, der Carnegie Mellon University in Pittsburgh und in Bonn. „Das ‚proximity labeling‘, bei dem ein Protein seine unmittelbaren Nachbarn wie mit einem Pinsel markiert, hat uns gezeigt, dass die Effektoren im Bakterium an die mobilen Injektisom-Bestandteile binden“, erklärt Endesfelder. Diese Bindung untersuchte ihr Team dann mittels „single particle tracking“, einer hochauflösenden Mikroskopiemethode. „Mit diesem Verfahren können wir einzelne Proteine verfolgen“, so Doktorand Alexander Balinovic von der Universität Bonn und ebenfalls Erstautor der Studie. „Wir markieren die Bestandteile, die wir verfolgen möchten, mit photoaktivierbaren fluoreszierenden Proteinen, so dass wir die einzelnen Teilchen in den Mikroskopieaufnahmen lokalisieren können.“ Erst diese Methoden, die das Team als „in situ biochemistry“, also biochemische Untersuchungen an Ort und Stelle, bezeichnet, erlaubten den Durchbruch, der jetzt im Fachjournal „Nature Microbiology“ publiziert wurde.