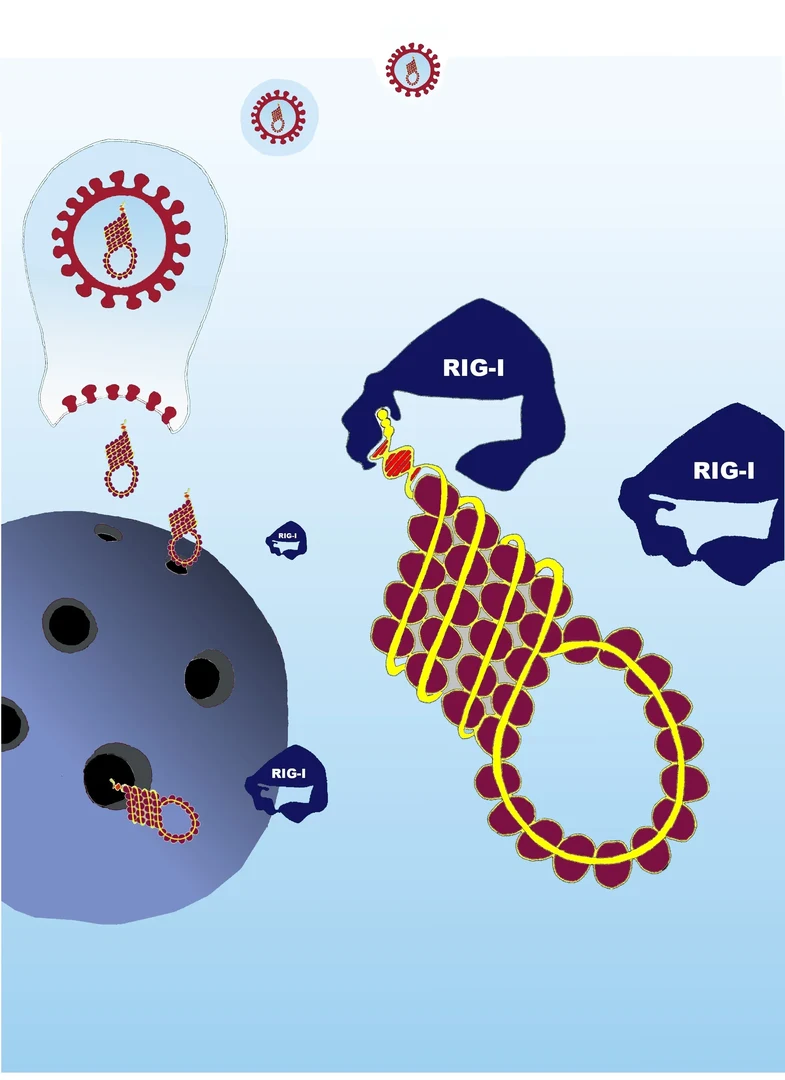
Wie Piraten entern sie den menschlichen Körper. Die Rede ist von Viren, die menschliche Zellen benötigen, um sich selbst zu reproduzieren, das heißt ihren Nachwuchs zu erzeugen. Dazu dringen sie in die Zelle ein und veranlassen sie, virales Erbmaterial sowie Viren-Protein herzustellen. Daraus formieren sich die Virenabkömmlinge, die dann in großer Zahl die Wirtszelle verlassen und sich wiederum neue Zellen im Körper zur Vermehrung suchen.
Die Menschheit hätte ohne effektive Abwehrmechanismen nicht bis heute überlebt. Zum Abwehrsystem des Menschen gehört das Rezeptor-Protein RIG-I. Es erkennt virales Erbgut, die so genannte RNA, und schlägt dann Alarm. Stark vereinfacht gesagt, lagert sich virale RNA an RIG-I an, wodurch sich die räumliche Gestalt des Proteins ändert. In dieser geänderten Form löst es als Immunantwort eine ganze Kaskade von Signalen in der Zelle aus, die letztendlich zur Ausschüttung von antiviralen Zytokinen wie Typ I-Interferon führen. Diese veranlassen einen Schutzmechanismus, der andere Zellen der Umgebung vor einem Angriff der Viren schützt.
Das Rezeptor-Protein RIG-I und seine Bedeutung für die Virusabwehr wurden erst vor wenigen Jahren in Bonn entdeckt. Jetzt konnte die Arbeitsgruppe um Professor Gunther Hartmann vom Institut für Klinische Chemie und Pharmakologie des Universitätsklinikums Bonn einen weiteren Erfolg vermelden: RIG-I sieht sich nämlich mit dem Problem konfrontiert, dass auch in menschlichen Zellen RNA vorkommt. RIG-I kann diese jedoch von viralem Erbgut unterscheiden. Die Bonner Forscher haben herausgefunden, wie es das macht. Demnach muss die Viren-RNA an einem Ende eine spezielle räumliche Konfiguration aufweisen: Sie ist dort ähnlich geformt wie ein Pfannenstiel. Nur dann kann sie das RIG-I maximal aktivieren.
„Das Verständnis der tatsächlichen molekularen Vorgänge bei der Erkennung von Viren erlaubt uns jetzt die gezielte Entwicklung von antiviralen und sogar antitumoralen RNA-basierten Therapeutika“, erläutert Professor Hartmann. Diese müssen als wesentliches Merkmal diese Pfannenstiel-Region besitzen. So kann die virale Infektion nachgeahmt werden, ohne dass ein schädigender Komplett-Virus anwesend ist. Man hilft dem Körper, sich selbst zu helfen, indem das Medikament eine Infektion simuliert und so die natürliche Immunantwort auslöst – also letztlich das Ausschütten von Zytokinen wie Interferon. „Das ist für den Patienten eine viel gezieltere und bessere Behandlung, als die Zytokine direkt zu verabreichen. Die Dosis stimmt dann genauer, weil der Körper durch Rückkopplungen im Regulationsmechanismus exakt weiß, wie viel Zytokin er zu welchem Zeitpunkt ausschütten muss“, erläutert Dr. Martin Schlee, Mitarbeiter in Hartmanns Team und Erstautor der Studie.
Der Clou ist, dass es dem Team um Professor Hartmann gelungen ist, den „Pfannenstil“ im Reagenzglas nachzubauen. Da dieser jetzt erstmals in chemisch reiner Form hergestellt werden konnte, ist sichergestellt, dass er in ausreichend großen Mengen zur Verfügung stehen wird.
Bis die auf diesem Mechanismus beruhenden Medikamente allerdings wirklich auf dem Markt sind, müssen noch klinische Studien durchgeführt werden. Hartmann und sein Team rechnen in etwa zehn Jahren mit den ersten Immuntherapie-Medikamenten gegen Hautkrebs, Grippe, Hepatitis B & Co.
Kontakt:
Professor Dr. med. Gunter Hartmann
Institut für Klinische Chemie und Pharmakologie
Universitätsklinikum Bonn
Telefon: 0228/28716080
E-Mail: gunther.hartmann@ubk.uni-bonn.de