Zunächst sind sie weniger als einen Millimeter groß und werden daher Mikrofilarien genannt – die Larven, die Fadenwürmer direkt im Gewebe ihres Wirts freisetzen. Um sich weiterzuentwickeln und infektiös zu werden, brauchen sie allerdings die Mithilfe von Mücken. Sie nehmen die Mikrofilarien des Wirts mit der Blutmahlzeit auf. Im Körper des Insekts entwickeln sich die Larven weiter und gelangen beim nächsten Stich wieder zum Menschen. Filarien können schwere Erkrankungen wie die Flussblindheit oder Elefantiasis (extreme Lymphschwellungen in den Beinen und/oder Hoden) hervorrufen, die zu den sogenannten Vernachlässigten Tropenkrankheiten gehören und dort bei etwa 80 Millionen Menschen vorkommen.
Um zu untersuchen, welche Mechanismen das Immunsystem gegen solche Eindringlinge einsetzt, sahen sich die Wissenschaftler in ihrer Studie bestimmte Immunzellen, die Eosinophilen Granulozyten, genauer an. Die Zellen haben ihren Namen aufgrund des roten Farbstoffs Eosin, mit dem sie angefärbt werden können. „Eosinophile Granulozyten sind bekannt dafür, dass sie bei Filarieninfektionen einen schützenden Effekt haben. Der genaue Mechanismus war bislang jedoch nicht bekannt“, sagt Studienleiter Prof. Dr. Marc P. Hübner vom Institut für Medizinische Mikrobiologie, Immunologie und Parasitologie am Universitätsklinikum Bonn und vom Deutschen Zentrum für Infektionsforschung (DZIF).
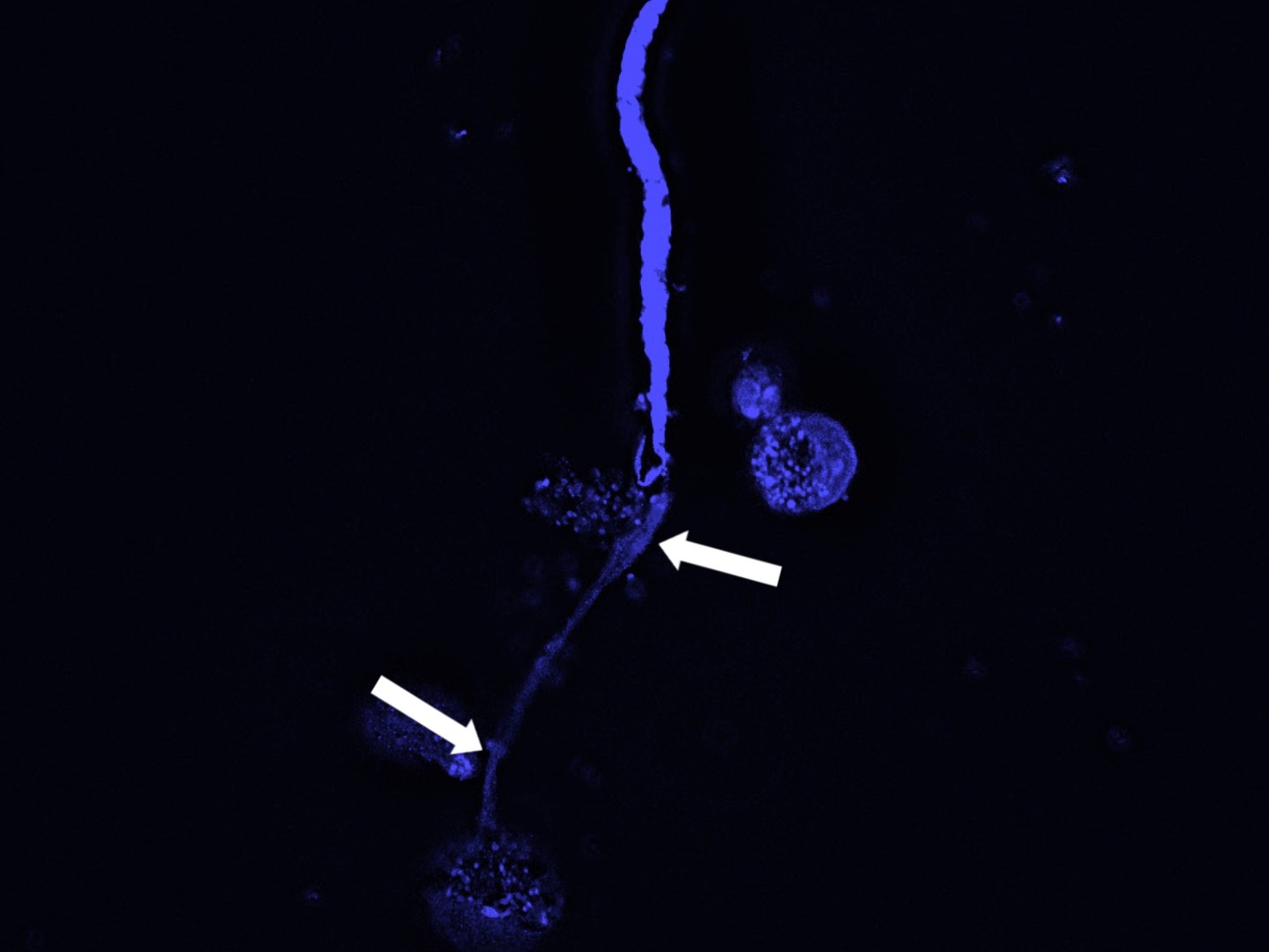
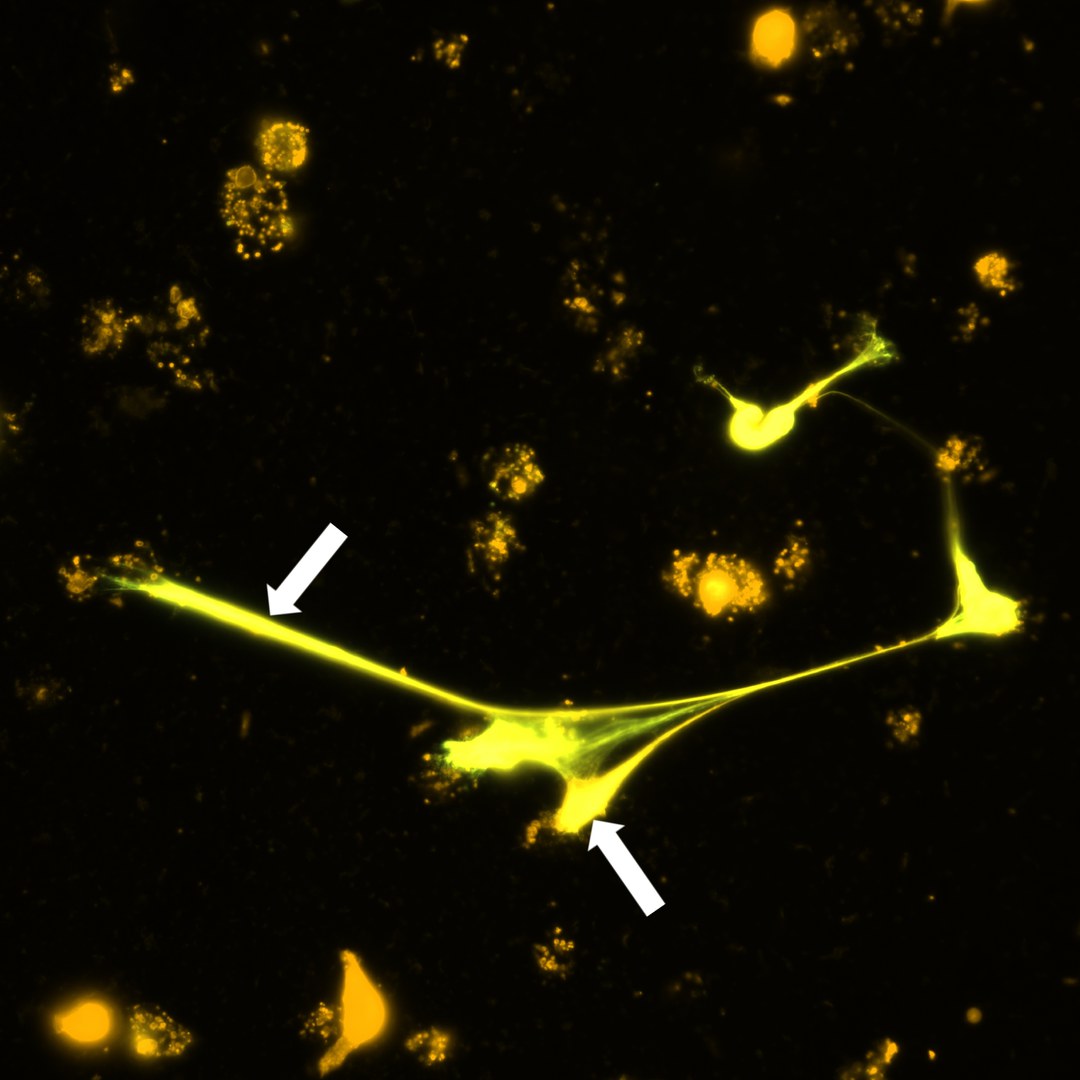
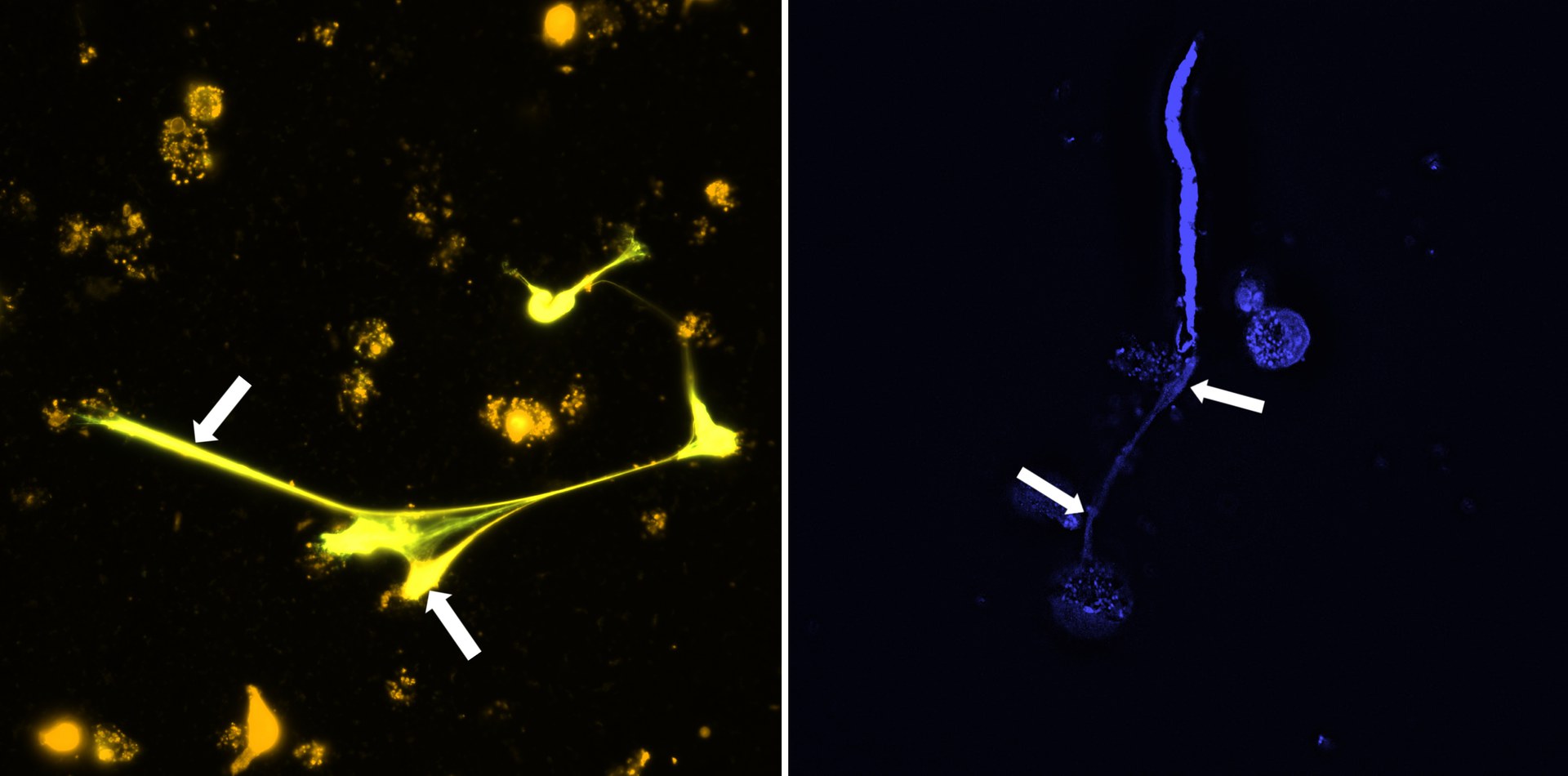
Die Forschenden nutzten unter anderem molekularbiologische Methoden und die Immunfluoreszenzmikroskopie, um die auftretende DNA zu bestimmen und zu messen. In Zellkulturen fanden sie heraus, dass die Immunzellen auf die Larven der Fadenwürmer reagierten – die Zellen produzierten DNA, die dann außerhalb der Zelle die Larven wie ein Netz umspannte. Das hatte zur Folge, dass sich die Larven nur noch schlecht oder gar nicht mehr bewegen konnten und dadurch unschädlich gemacht wurden. Der Mechanismus trat sowohl bei freigesetzten Mikrofilarien (erstes Larvenstadium) als auch bei weiterentwickelten Larven in einem bereits infektiösen Stadium (drittes Larvenstadium) auf. Das könnte die Verbreitung der Parasiten reduzieren, denn die übertragenden Insekten treffen in der Folge weniger Mikrofilarien an. Hinzu kommt, dass die vom Insekt übertragenen infektiösen Larven im Endwirt besser bekämpft werden.
Auch in einem darauffolgenden Versuch mit Mäusen bestätigte sich die Beobachtung der Wissenschaftler, dass Mikrofilarien durch DNA-Netze abgebaut werden können. Umgekehrt bildeten sich in Mäusen, denen die Eosinophilen Granulozyten fehlten, keine DNA-Netze gegen die Larven.
Der Mechanismus von Immunzellen, solche Netze aus DNA zu entwickeln, nennt sich ETosis – ET steht dabei für extracellular traps, also extrazelluläre Fallen. Der Prozess der ETosis ist schon länger bekannt, wurde bisher aber vor allem in anderen Immunzellen, den Neutrophilen Granulozyten, nachgewiesen.
Rezeptor erkennt Larven und löst Schutzmechanismus aus
Aber was lässt die Zellen die Gefahr der Larven erkennen und DNA-Netze freisetzen? Die Wissenschaftler fanden heraus, dass es ein bestimmtes Protein auf der Zelloberfläche ist – der Dectin-1 Rezeptor. Wenn die Zellen in Kontakt mit den Wurmlarven kommen, wird er in Gang gesetzt und löst den Mechanismus aus, bestehend aus einer Reihe aufeinanderfolgender Signale. Aus welchen Teilen der Zelle die freigesetzte DNA stammt, konnten die Wissenschaftler ebenfalls herausfinden: Die primäre Quelle sind die Mitochondrien, die „Kraftwerke“ der Zelle. Aber auch aus dem Zellkern wurde DNA in die Netze eingespeist – freigesetzt durch biochemische Veränderungen.
„Unsere Ergebnisse belegen, dass die Eosinophile ETosis ein konservierter Mechanismus ist. Das zeigt sich daran, dass sowohl menschliche als auch tierische Eosinophile Granulozyten in der Lage sind, ihre DNA freizusetzen, wenn sie in Kontakt mit Filarien verschiedener Spezies kommen“, betont Erstautorin Dr. Alexandra Ehrens von der Universität Bonn.
Die Ergebnisse der Studie können zukünftig dazu beitragen, Strategien gegen die Verbreitung von Krankheiten zu finden, die durch Filarien ausgelöst werden. In Folgestudien wollen die Wissenschaftler untersuchen, welche Relevanz der entdeckte Abwehrmechanismus für die Bekämpfung solcher Filariosen in Afrika haben kann.
Beteiligte Institutionen und Förderung:
An der Studie waren neben der Universität Bonn und dem DZIF in Bonn das Muséum National d'Histoire Naturelle in Paris (Frankreich) und das Unternehmen Elanco Animal Health in Monheim beteiligt. Marc Hübner ist auch Mitglied des Transdisziplinären Forschungsbereichs (TRA) „Leben und Gesundheit“ der Universität Bonn. In sechs verschiedenen TRAs kommen Wissenschaftler aus den unterschiedlichsten Fakultäten und Disziplinen zusammen, um gemeinsam an zukunftsrelevanten Forschungsthemen der Exzellenzuniversität zu arbeiten.
Finanzielle Unterstützung erhielt die Studie von der Deutschen Forschungsgemeinschaft (DFG) und dem von der DFG geförderten Exzellenzcluster ImmunoSensation2 an der Universität Bonn sowie von der Jürgen Manchot Stiftung.
Publikation: Alexandra Ehrens, Benjamin Lenz, Anna-Lena Neumann, Samuela Giarrizzo, Julia Jennifer Reichwald, Stefan Julian Frohberger, Wiebke Stamminger, Benedikt Christian Buerfent, Frédéric Fercoq, Coralie Martin, Daniel Kulke, Achim Hoerauf & Marc Peter Hübner: Microfilariae Trigger Eosinophil Extracellular DNA Traps in a Dectin-1-Dependent Manner. Cell Reports; DOI: 10.1016/j.celrep.2020.108621
Link zur Studie: https://www.cell.com/cell-reports/pdf/S2211-12471(20)31610-7.pdf
Kontakt:
Prof. Dr. Marc Hübner
Institut für Medizinische Mikrobiologie, Immunologie und Parasitologie
Universität Bonn, Universitätsklinikum Bonn
Deutsches Zentrum für Infektionsforschung
Tel.: 0228 287 19177
E-Mail: huebner@uni-bonn.de
Dr. Alexandra Ehrens
Institut für Medizinische Mikrobiologie, Immunologie und Parasitologie
Universität Bonn, Universitätsklinikum Bonn
Tel.: 0228 287 19155
E-Mail: aehrens@uni-bonn.de