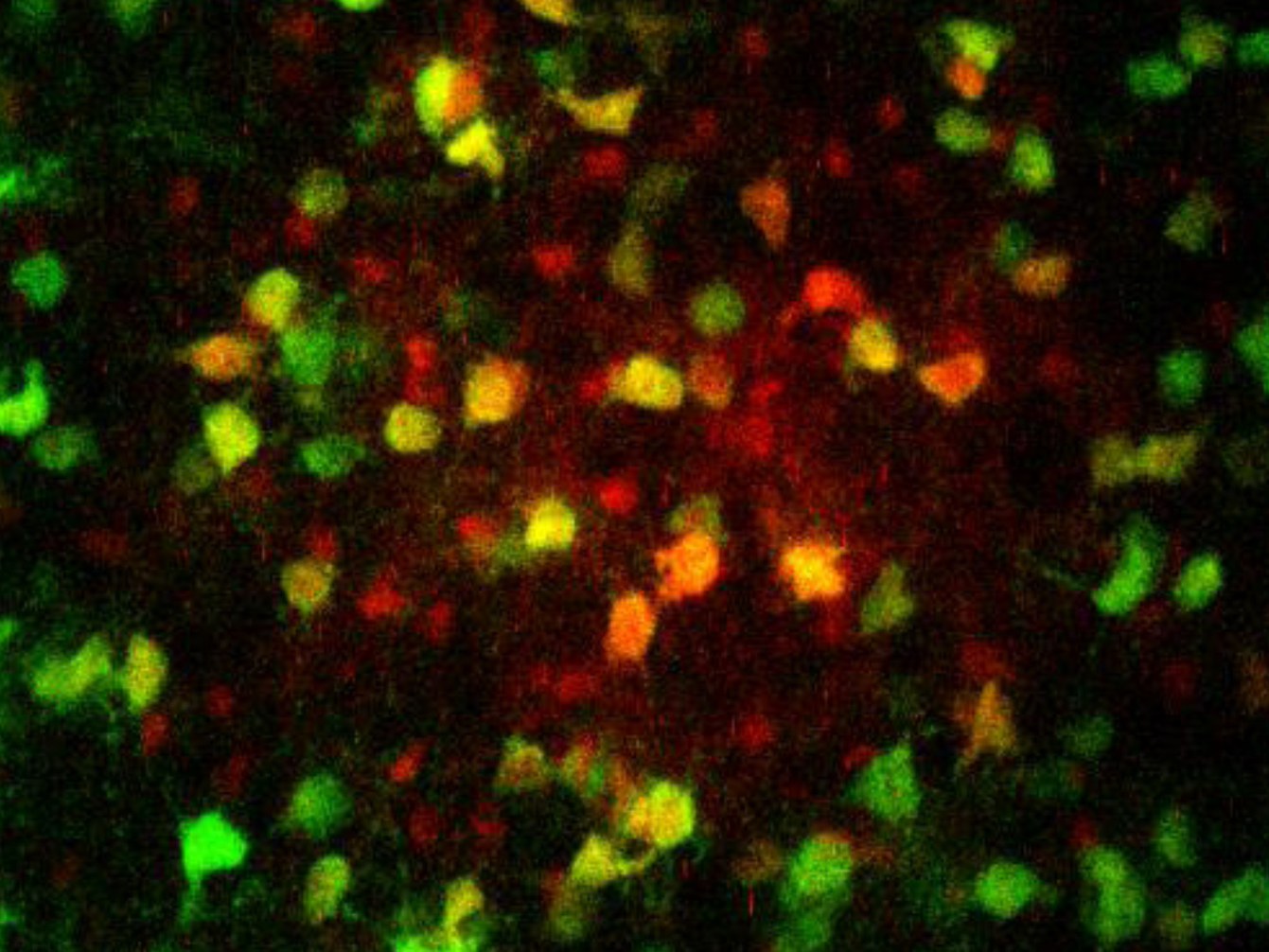
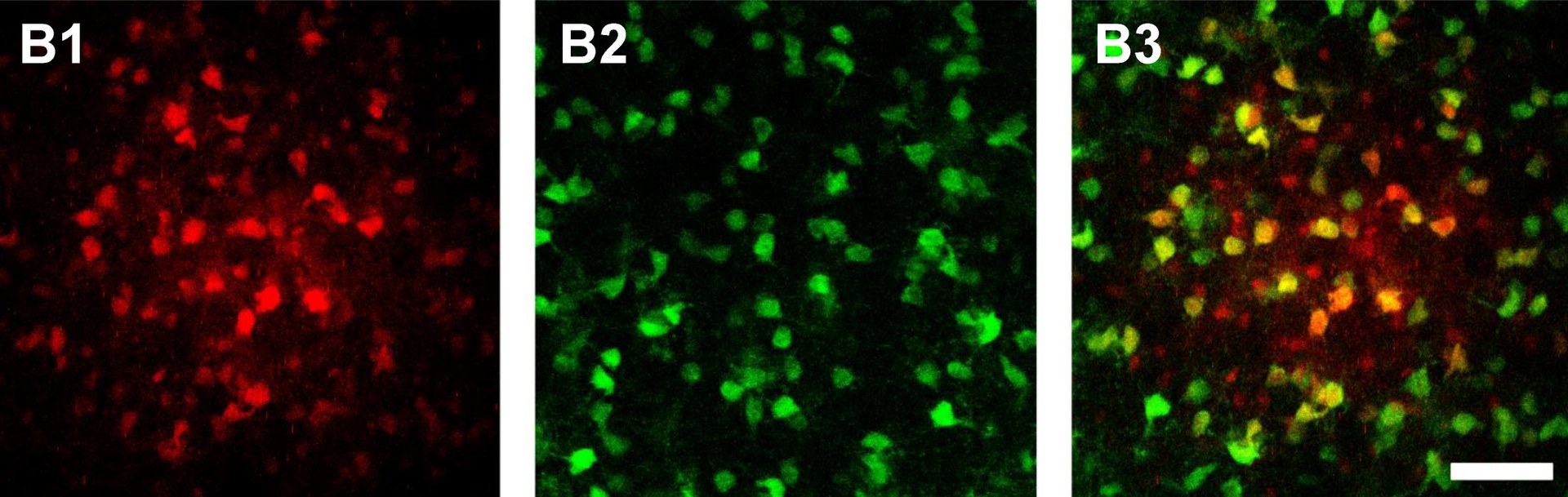
Im menschlichen Gehirn existieren etwa ebenso viele Neuronen wie Gliazellen. Diese unterteilen sich in vier große Gruppen: die Microglia, die Astrozyten, die NG2-Gliazellen und die Oligodendrozyten. Oligodendrozyten fungieren vor allem als eine Art zelluläres Isolierband: Sie bilden lange Arme, die größtenteils aus fettähnlichen Substanzen bestehen und Strom nicht leiten. Diese umwickeln die Axone – das sind die Ausläufer, über die die Nervenzellen ihre elektrischen Impulse verschicken. Dadurch verhindern sie Kurzschlüsse und beschleunigen die Signal-Weiterleitung.
Astrozyten dagegen versorgen unter anderem die Nervenzellen mit Energie: Sie treten über ihre Fortsätze mit Blutgefäßen in Kontakt und nehmen aus ihnen Glucose auf. Diese transportieren sie dann an die Schnittstellen zwischen zwei Neuronen, die Synapsen. Vorher wandeln sie den Zucker zum Teil in andere energiereiche Moleküle um. „Wir konnten nun zeigen, dass Oligodendrozyten bei der Verteilung dieser Verbindungen eine wichtige Rolle spielen“, erklärt Prof. Dr. Christian Steinhäuser vom Institut für Zelluläre Neurowissenschaften der Universität Bonn. „Das gilt augenscheinlich vor allem in einer bestimmten Hirnregion, dem Thalamus.“
Riesiges Versorgungsnetzwerk
Der Thalamus wird auch als „Tor zum Bewusstsein“ bezeichnet. In ihm laufen unter anderem sensorische Signale aus Ohren, Augen und Haut ein. Er leitet sie dann an die jeweils zuständigen Zentren der Großhirnrinde weiter. Erst dann werden uns diese Informationen – also etwa der Klang eines Instruments – bewusst.
Es ist seit langem bekannt, dass Astrozyten enge Verbindungen eingehen können: Sie bilden durch tunnelartige Kopplungen interzelluläre Netzwerke aus. Durch diese „Gap Junctions“ können Moleküle von einer Zelle zur anderen wandern. Steinhäuser und seine Mitarbeiter haben vor einigen Jahren zeigen können, dass es im Thalamus auch Oligodendrozyten in diesen Netzwerken gibt – etwa genauso viele wie Astrozyten. Auf diese Weise formen die Zellen dort einen riesigen Verbund, den Neurowissenschaftler auch als „pangliales Netzwerk“ bezeichnen („pan“ kommt aus dem Griechischen und bedeutet „umfassend“). In anderen Regionen bestehen die Netzwerke hingegen vorwiegend aus gekoppelten Astrozyten. „Wir wollten wissen, warum das hier anders ist“, erklärt Dr. Camille Philippot aus Steinhäusers Arbeitsgruppe, die einen großen Teil der Arbeiten durchgeführt hat. „Unsere Ergebnisse belegen, dass die energiereichen Verbindungen durch dieses Netzwerk von den Blutgefäßen zu den Synapsen gelangen“, betont Philippot. „Und die Oligodendrozyten scheinen dabei unverzichtbar zu sein.“
Das konnten die Wissenschaftler zum Beispiel an Mäusen zeigen, bei denen sich die Oligodendrozyten nicht an dem Netzwerk beteiligen können, weil ihnen dazu die passenden Tunnel fehlen. In diesen Mäusen gelangten Energie-Moleküle nicht mehr in ausreichender Menge an die Synapsen. Fehlten den Astrozyten die passenden Anschlussverbindungen, war es genauso. „Der Thalamus benötigt für den Transport augenscheinlich beide Zelltypen“, folgert Steinhäuser.
Ausgehungerte Neuronen können nicht kommunizieren
Die Wissenschaftler konnten auch zeigen, welche Konsequenzen eine so gestörte Energieversorgung für die neuronale Informationsverarbeitung hat. An den Synapsen treffen zwei Neuronen aufeinander – eine Sender-und eine Empfänger-Zelle. Trifft ein Puls aus der Senderzelle an der Synapse ein, gibt diese Botenmoleküle in den synaptischen Spalt ab. Die Neurotransmitter docken an die Empfängerzelle an und lösen dort elektrische Signale aus, die postsynaptischen Potenziale. Bei der Erzeugung dieser Signale treten geladene Kalium- und Natrium-Ionen durch die Membran der Empfängerzelle – Natrium nach innen, Kalium nach außen. Diese müssen, ebenso wie die Neurotransmitter, anschließend wieder zurückgepumpt werden.
„Und dafür benötigen die Neuronen Energie“, erklärt Steinhäuser, der auch Mitglied des Transdisziplinären Forschungsbereichs „Leben und Gesundheit“ der Universität Bonn ist. „Wenn sie fehlt, kommt die Pump-Aktivität zum Erliegen.“ In den Experimenten waren „ausgehungerte“ Neuronen daher bereits nach einigen Minuten nicht mehr dazu in der Lage, postsynaptische Aktivität zu erzeugen.
Die Ergebnisse der Grundlagenarbeit erlauben es, die Prozesse bei der Signalverarbeitung im Gehirn besser zu verstehen. Möglicherweise werfen sie auch ein neues Licht auf Erkrankungen, bei denen die Oligodendrozyten nicht richtig funktionieren.
Förderung:
Die Studie wurde durch die Deutsche Forschungsgemeinschaft (DFG) gefördert.
Publikation: Camille Philippot, Stephanie Griemsmann, Ronald Jabs, Gerald Seifert, Helmut Kettenmann und Christian Steinhäuser: Astrocytes and oligodendrocytes in the thalamus jointly maintain synaptic activity by supplying metabolites. Cell Reports, https://doi.org/10.1016/j.celrep.2020.108642
Kontakt:
Prof. Dr. Christian Steinhäuser
Institut für Zelluläre Neurowissenschaften, Medizinische Fakultät, Universität Bonn
Tel.: 0228-287-14669
E-Mail: cste@uni-bonn.de oder Christian.Steinhaeuser@ukb.uni-bonn.de