Virale Bestandteile werden im menschlichen Körper von so genannten Pattern Recognition Rezeptoren (PRRs) innerhalb der Zelle oder auf der Zelloberfläche erkannt. Diese lösen bei Aktivierung eine Signalkaskade aus, die letztendlich in der Produktion von Signalmoleküle wie Interferonen und Zytokinen und deren Ausschüttung mündet. Diese Botenstoffe alarmieren benachbarte Immunzellen und machen sie auf die Virusinfektion aufmerksam, so dass eine Immunreaktion erfolgt.
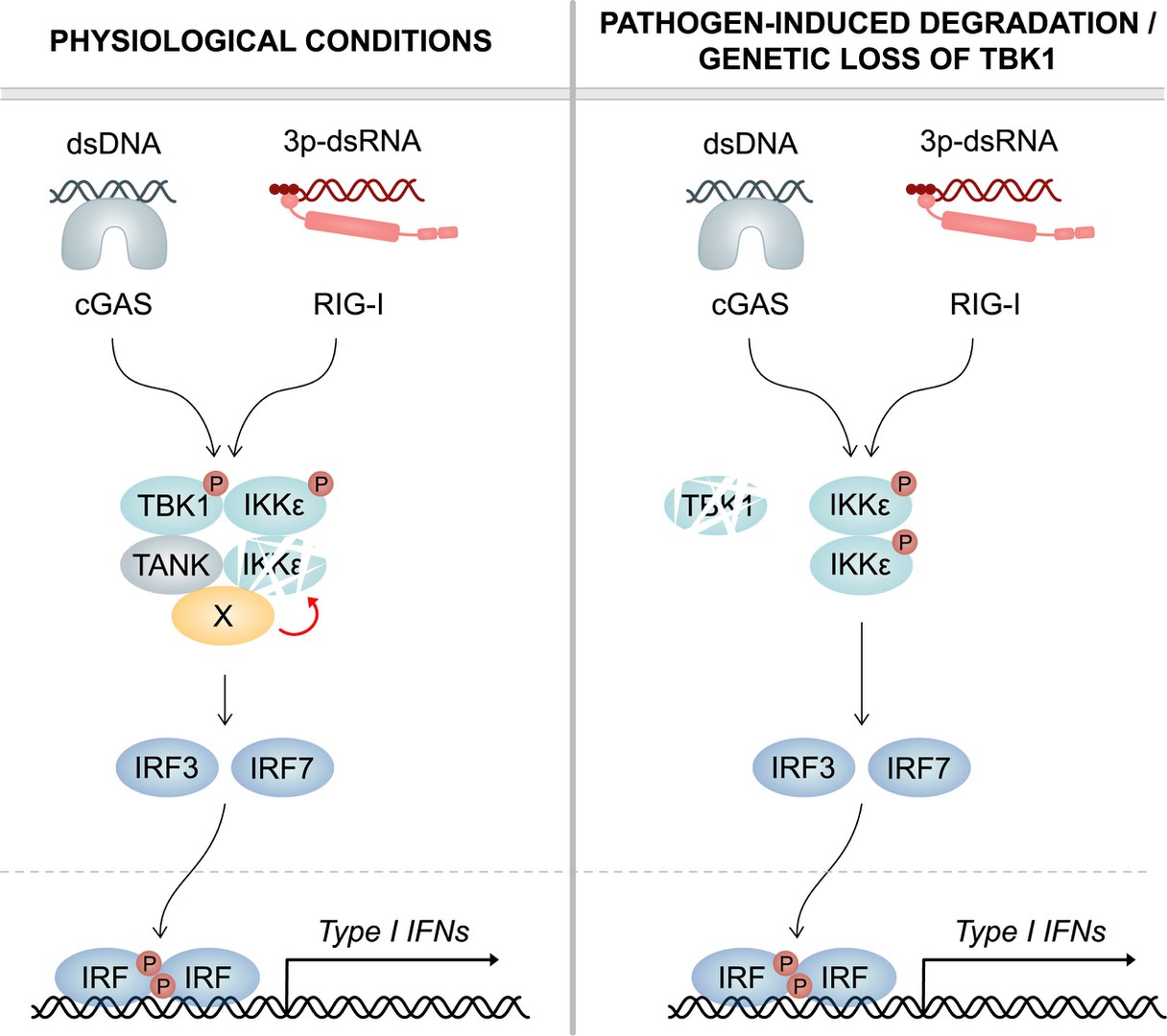
Bestandteil dieser Signalkaskade ist das Enzym TANK Binding Kinase 1 (TBK1). Werden virale Bestandteile durch PRRs erkannt, wird TBK1 aktiviert. TBK1 setzt wiederum zwei Transkriptionsfaktoren in Gang, die in den Zellkern wandern und dort die Transkription von Interferon- und Zytokin-Genen anwerfen.
Anfälligkeit für Virusinfektionen
Punktmutationen im TBK1-Gen können zu einem Funktionsverlust von TBK1 führen. Dieser schlägt sich beim Menschen in einer klinischen Anfälligkeit für Virusinfektionen nieder. Erstaunlicherweise ist dieser Effekt nicht zu beobachten, wenn TBK1 nicht exprimiert wird und somit in der Zelle fehlt. „Ein vollständiges Fehlen der TBK1-Expression beim Menschen ist überraschenderweise nicht mit einer verminderten antiviralen Reaktion verbunden“, sagt Prof. Martin Schlee vom Institut für Klinische Chemie und Klinischen Pharmakologie am Universitätsklinikum Bonn. Bislang war unklar, warum ein vollständiger Verlust der TBK1-Expression hinsichtlich der Immunkompetenz besser toleriert wird als eine Mutation von TBK1, die die Kinase-Funktion betrifft.
Die Bonner Forscher konnten nun eine Erklärung für diese bisher unerklärte Beobachtung liefern. „Dabei spielt ein zweites Enzym, das der TBK1 sehr ähnlich ist, eine wichtige Rolle: die IkB kinase epsilon, oder kurz IKKepsilon,“ erklärt Dr. Julia Wegner, Erstautorin der Studie. Genau wie TBK1 ist IKKepsilon den PRRs nachgeschaltet und kontrolliert die Expression von Interferonen. Auch in ihrem Aufbau sind sich die beiden Proteine sehr ähnlich und weisen eine Sequenzhomologie von über 60 Prozent auf. Neu ist der Befund, dass TBK1 einen direkten Einfluss auf IKKepsilon hat. „In myeloiden Zellen konnten wir zeigen, dass TBK1 die Expression der verwandten Kinase IKKepsilon reguliert“, ergänzt Dr. Wegner.
Keine halben Sachen
TBK1 verringert die Stabilität von IKKepsilon. Dieser Vorgang ist von der enzymatischen Funktion des Proteins unabhängig. „Ein durch Punktmutation nichtfunktionales TBK1 ist entsprechend trotzdem in der Lage, IKKepsilon zu destabilisieren“, erklärt Prof. Gunther Hartmann, Direktor des Instituts für Klinische Chemie und Klinische Pharmakologie und Sprecher des Exzellenzclusters ImmunoSensation2. „Dies führt in menschlichen Immunzellen zu einem kontinuierlichen Abbau der Kinase IKKepsilon.“
Zusammengefasst führt also der Verlust der TBK1-Expression zu einem erhöhten Vorkommen von IKKepsilon. Dieser Mechanismus stellt sicher, dass trotz Abwesenheit von TBK1 eine antivirale Immunreaktion ablaufen kann. Ein durch Punktmutationen herbeigeführter Funktionsverlust von TBK1 hingegen verhindert die Destabilisierung und den Abbau von IKKepsilon nicht, so dass letztendlich beide Faktoren in der Virusabwehr fehlen. Eine erhöhte Anfälligkeit für Virusinfektionen ist die Folge.
Die Waffen eines Virus
Im gesunden Organismus können also erhöhte Mengen der Kinase IKKepsilon den Verlust von TBK1 ausgleichen. Das ist besonders wichtig, wenn Viren die körpereigene Abwehr gezielt ausschalten wollen. Das Herpes-Simplex Virus 1 (HSV-1), das Humane Immundefizienz Virus (HIV), aber auch das Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) sind in der Lage, TBK1 gezielt auszuschalten. Auch sind verschiedene Bakterienarten in der Lage, den Abbau von TBK1 zu bewirken. „Unsere Daten zeigen eindeutig, dass menschliche Immunzellen über einen wichtigen Backup-Mechanismus verfügen“, erläutert Dr. Wegner. „Sie sind in der Lage, eine effektive antivirale Antwort aufrecht zu erhalten, auch wenn es zu einem pathogen-induzierten Abbau von TBK1 kommt. Darüber hinaus greift der Mechanismus auch bei genetischem Verlust von TBK1“.