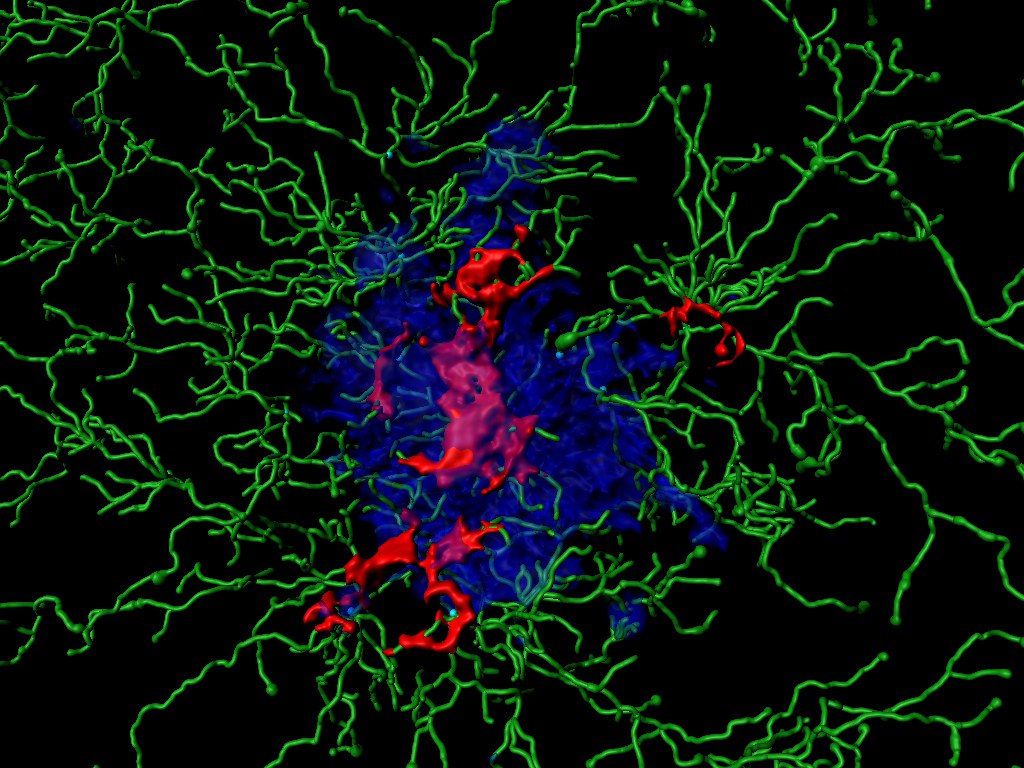
Charakteristisch für die Alzheimer-Erkrankung sind Verklumpungen des Proteins Aß, die dann im Gehirn große Ablagerungen bilden. Aß ähnelt Molekülen auf der Oberfläche mancher Bakterien. Im Laufe vieler Millionen Jahre haben Organismen daher gegen solche Strukturen Abwehrmechanismen entwickelt. Diese sind genetisch festgelegt und zählen somit zum so genannten angeborenen Immunsystem. Sie führen in der Regel dazu, dass bestimmte Fresszellen das Molekül in sich aufnehmen und verdauen.
Im Gehirn übernehmen die Mikroglia-Zellen diese Rolle. Damit stoßen sie aber einen fatalen Prozess an, der für die Entwicklung der Demenz-Erkrankung maßgeblich mitverantwortlich zu sein scheint. Bei Kontakt mit Aß werden in den Mikroglia-Zellen bestimmte Molekül-Komplexe aktiv, die Inflammasomen. Sie ähneln dann einem Rad, an dessen Außenseite Enzyme sitzen. Diese können Immun-Botenstoffe aktivieren und dadurch eine Entzündung auslösen, indem sie weitere Immunzellen zum Ort des Geschehens dirigieren.
„Mitunter gehen die Mikroglia-Zellen bei diesem Prozess zugrunde“, erklärt Prof. Dr. Michael Heneka, Arbeitsgruppenleiter am Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) und Direktor der Klinik für Neurodegenerative Erkrankungen und Gerontopsychiatrie am Universitätsklinikum Bonn. „Sie geben dann aktivierte Inflammasomen in ihre Umgebung ab, die ASC-Specks.“
Verhängnisvolle Doppelrolle
Diese freigewordenen Specks übernehmen eine unheilvolle Doppelrolle: Einerseits verbinden sie sich mit den Aß-Proteinen und erschweren dadurch ihren Abbau. Andererseits aktivieren sie die Inflammasomen in weiteren Mikroglia-Zellen, und zwar weit stärker, als Aß allein es tun würde. Bei diesem Prozess werden immer weitere ASC-Specks frei. Er gießt also gewissermaßen Öl ins Feuer und facht dadurch die Entzündung dauerhaft an. „Ein prinzipiell sinnvoller Immun-Mechanismus wird so zu einem wesentlichen Faktor, der die Entstehung der Alzheimer-Erkrankung fördert“, betont Heneka.
Dass ASC-Specks nach dem Zelltod aktiv bleiben, ist eigentlich erwünscht: Sie können dann nämlich von anderen Immunzellen aufgenommen und weiter genutzt werden. „Diese müssen dann keine eigenen Inflammasomen herstellen und können so beispielsweise schneller auf den bakteriellen Infekt reagieren“, sagt Heneka. Im Gehirn ist dieser Mechanismus aber wenig sinnvoll: Nervenzellen produzieren ständig geringe Mengen Aß. Möglicherweise werden diese Ablagerungen erst in Kombination mit den ASC-Specks zu einer ernsten Gefahr für die Funktion des Gehirns.
Die Wissenschaftler hoffen, dass ein besseres Verständnis dieser Prozesse auch zur Entwicklung neuer Therapie-Ansätze führen könnte. Denn die Ablagerung von Aß beginnt wahrscheinlich Jahrzehnte, bevor erste Krankheitssymptome auftreten. Durch einen frühzeitigen Eingriff lässt sich dieser verhängnisvolle Prozess möglicherweise verlangsamen. „Eventuell ist es so in Zukunft möglich, Alzheimer präventiv zu behandeln, so dass es gar nicht erst zu Beeinträchtigungen der geistigen Leistungsfähigkeit kommt“, hofft Prof. Heneka.
Publikation: Lea L. Friker, Hannah Scheiblich, Inga V. Hochheiser, Rebecca Brinkschulte, Dietmar Riedel, Eicke Latz, Matthias Geyer und Michael T. Heneka: Amyloid Clustering around ASC Fibrils Boosts Its Toxicity in Microglia; Cell Reports; DOI: 10.1016/j.celrep.2020.02.025
Kontakt:
Prof. Dr. Michael Heneka,
Direktor der Klinik für Neurodegenerative Erkrankungen und Gerontopsychiatrie Universitätsklinikum Bonn
Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE)
Tel.: 0228/287-13091
E-Mail: michael.heneka@dzne.de