Als der Augustinermönch Gregor Mendel Mitte des 19. Jahrhunderts weiß blühende mit violett blühenden Erbsenpflanzen kreuzte, machte er eine interessante Entdeckung: Die Nachkommen waren sämtlich violett. Er nannte dieses Merkmal daher dominant, die weiße Blütenfarbe dagegen rezessiv. Der Grund für dieses Phänomen: In Erbsen kommt jedes Gen doppelt vor. Eine Version stammt von der mütterlichen und die andere von der väterlichen Pflanze. Wenn nun eine Erbse von einem Elternteil die Erbanlage für violette Blütenfarbe geerbt hat, von dem anderen aber die Erbanlage für weiße Blütenfarbe, gewinnt das Violett. Nur wenn in der Tochterpflanze zwei Erbanlagen für weiße Blüten zusammenkommen, wird sie weiß.
Auch im Menschen gibt es Gene, die sich entweder dominant oder rezessiv vererben. Bei den in der Studie untersuchten Mutationen ist der Fall dagegen nicht so klar: Manche von ihnen sind dominant – es reicht also, wenn entweder das von der Mutter stammende Gen oder das vom Vater mutiert ist, damit sich die Veränderung auswirkt. Andere sind dagegen rezessiv. „Diese Beobachtung hat man zwar auch schon vereinzelt bei anderen Genen gemacht, sie kam aber dennoch unerwartet“, erklärt Dr. Gabriel Dworschak, Kinderarzt der Universitätskinderklinik, der seine wissenschaftlichen Arbeiten am Institut für Anatomie und am Institut für Humangenetik der Universität Bonn durchgeführt hat.
Fehlbildungen von Gehirn und Augen
Die Erbanlage war in den Fokus der Wissenschaftler geraten, als sie am Universitätsklinikum Bonn ein Mädchen mit gravierenden Fehlbildungen der Speiseröhre, des Gehirns und der Augen untersucht hatten. Bei einer genetischen Analyse entdeckten sie, dass bei ihr das Plexin-A1-Gen gegenüber Gesunden verändert war. „In einer Datenbank haben wir dann nach weiteren Betroffenen mit Mutationen im Plexingen gefahndet“, erläutert Prof. Dr. Heiko Reutter, Arzt an der Universitätskinderklinik und Mitarbeiter am Institut für Humangenetik.
Inzwischen haben die Forschenden auf diese Weise insgesamt zehn Patientinnen und Patienten gefunden; sie stammen aus sieben Familien. „Bei allen Betroffenen waren unterschiedliche Teile des Plexin-A1-Gens verändert“, betont Dworschak. „Fünf dieser Mutationen vererben sich rezessiv; die restlichen drei sind dominant.“ Dank weiterer Analysen ahnen die Wissenschaftler inzwischen auch, warum das so ist: Das Plexin-A1-Gen enthält die Bauanleitung für einen Rezeptor. Er sitzt in der Membran, die die Nervenzellen wie ein dünnes Häutchen umgibt. An seiner Außenseite können bestimmte Botenmoleküle andocken. Dadurch wird dann an dem anderen Ende des Rezeptors, das in die Zelle hineinragt, eine Reaktion ausgelöst.
„Wenn eine Mutation die Außenseite des Rezeptors betrifft, kann er keine Signale mehr empfangen“, spekuliert Dworschak. „Ist davon aber nur eine der beiden Plexin-A1-Versionen betroffen, gibt es genügend intakte Rezeptoren, die das kompensieren können.“ Mutationen auf der Außenseite sind daher vermutlich rezessiv. Ein Fehler auf der Innenseite des Rezeptors kann dagegen zu einer gravierenden Fehlsteuerung der Zelle führen. Womöglich reicht es, wenn nur eine Version des Plexin-A1-Gens auf diese Weise verändert ist, um erheblichen Schaden anzurichten. „Wir denken daher, dass solche Mutationen dominant sind, und sprechen dann von einem dominant negativen Effekt“, sagt Dworschak.
Unterschiedliche Symptome
Insgesamt zeigen die Betroffenen ein breites Spektrum an Symptomen. Allen gemeinsam ist jedoch, dass bei ihnen die Hirnentwicklung in einem unterschiedlichen Ausmaß gestört ist. Auch Augen und Haut weisen bei vielen von ihnen Fehlbildungen auf. „Es war bekannt, dass das Plexin-A1-Gen beim Wachstum der Nervenzell-Ausläufer wichtig ist“, erklärt Reutter. „Für die Entwicklung vieler Organe spielt die Aussprossung von Nerven eine wesentliche Rolle. Die beobachteten Fehlbildungen bei den betroffenen Personen könnten daher durch die gestörte Entwicklung bestimmter Nervenfasern bedingt sein.“ Eine Folgestudie am Institut für Anatomie widmet sich derzeit dieser Fragestellung.
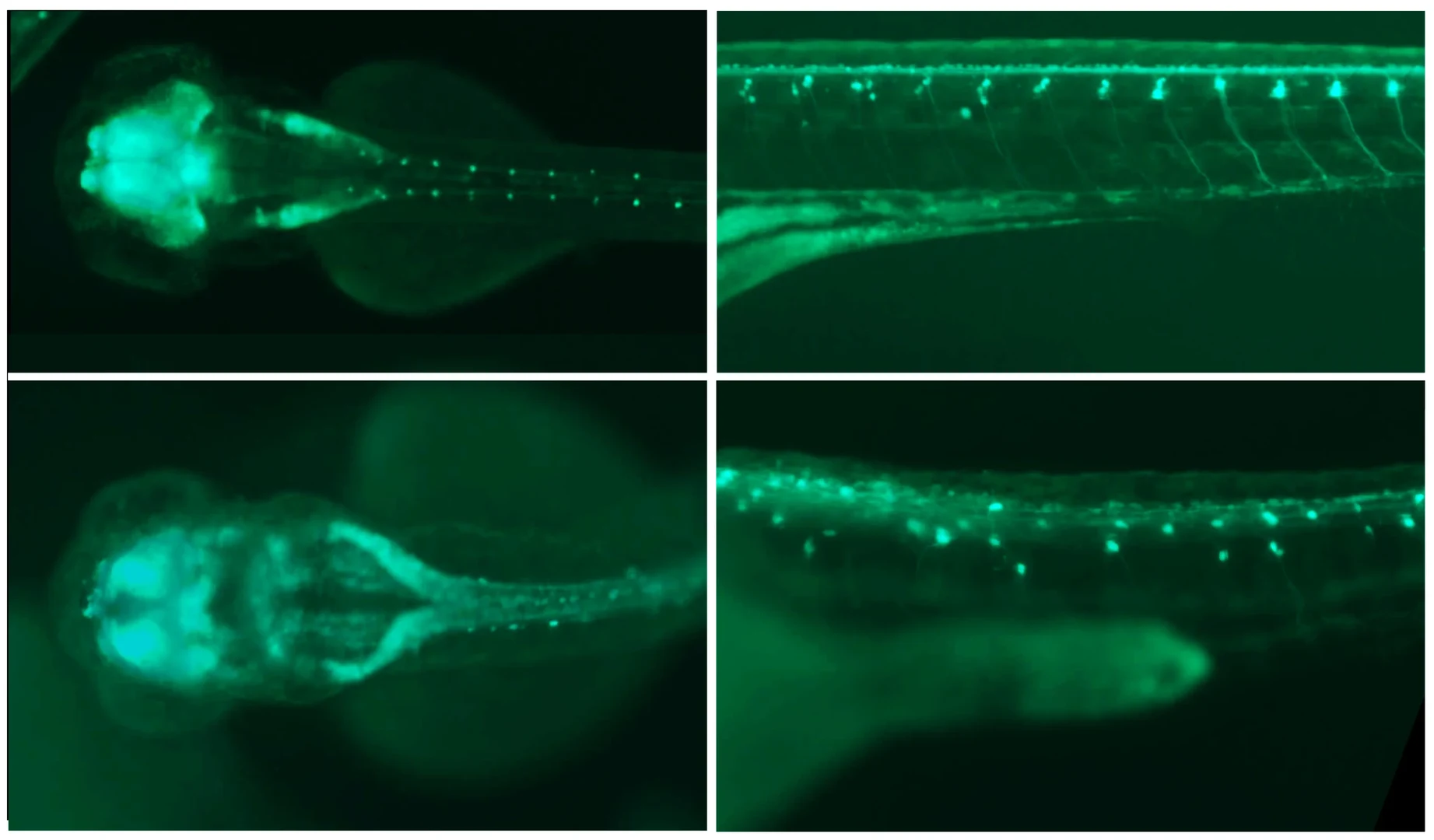
Das Plexin-A1-Gen übernimmt nicht nur bei uns eine wichtige Funktion, wie Untersuchungen an einer ganz anderen Art zeigen. Die Forschenden nutzten dazu die Expertise der Arbeitsgruppe um Prof. Dr. Benjamin Odermatt vom Institut für Neuroanatomie. Als Modellorganismus dient hier der Zebrafisch – nicht nur, weil er sich einfach artgerecht halten und schnell vermehren lässt: Viele seiner Gene kommen in ähnlicher Form auch beim Menschen vor. Dazu zählt auch das Plexin-A1-Gen. „Wenn wir diese Erbanlage im Zebrafisch ausschalten, zeigen sich ähnliche Störungen der Gehirnentwicklung wie beim Menschen“, erklärt Dworschak. Er hofft, dass die Ergebnisse der Studie dabei helfen, die komplexen Vorgänge bei der Entwicklung des Gehirns besser zu verstehen.
Beteiligte Institutionen und Förderung:
An der Studie waren Institutionen aus den USA, der Türkei, Indien, Saudi-Arabien, Pakistan, Großbritannien, Australien, Frankreich, Kanada, Italien und Deutschland beteiligt. Dr. Jaya Punetha vom Baylor College of Medicine in Texas ist zusammen mit Gabriel Dworschak leitende Autorin der Studie. Die Arbeiten wurden unter anderem von der Deutschen Forschungsgemeinschaft (DFG) sowie durch verschiedene Fördereinrichtungen in den beteiligten Ländern unterstützt.
Publikation: Gabriel C. Dworschak et al.: Biallelic and monoallelic variants in PLXNA1 are implicated in a novel neurodevelopmental disorder with variable cerebral and eye anomalies; Genetics in Medicine; DOI: 10.1038/s41436-021-01196-9; https://rdcu.be/clB9m