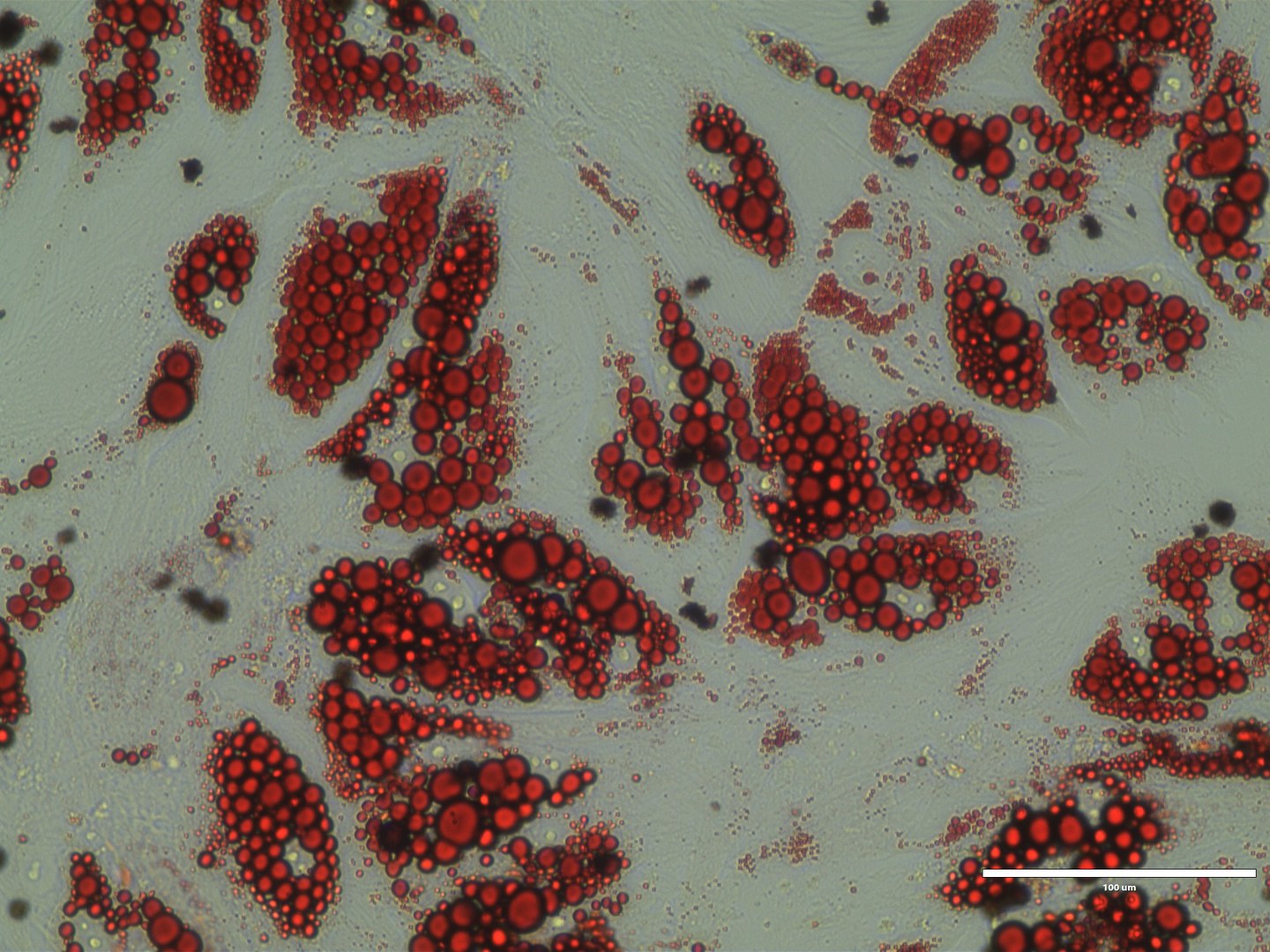
Normalerweise speichern Fettzellen Energie. In braunen Fettzellen dagegen verpufft sie dagegen als Wärme - braunes Fett dient uns also gewissermaßen als biologische Heizung. Unter kalten Bedingungen ist das nicht nur praktisch, sondern überlebenswichtig. Die meisten Säugetiere verfügen daher über diesen Mechanismus. Auch Menschen besitzen braunes Fett. Seine Aktivierung schützt zusätzlich vor Herz-Kreislauf-Erkrankungen.
„Heutzutage haben wir es aber selbst im Winter muckelig warm“, erklärt Prof. Dr. Alexander Pfeifer vom Institut für Pharmakologie und Toxikologie des Universitätsklinikums Bonn. „Unsere körpereigenen Verbrennungsöfen werden also kaum noch gebraucht.“ Gleichzeitig ernähren wir uns immer energiereicher und bewegen uns zudem weit weniger als unsere Vorfahren. Diese drei Faktoren sind Gift für braune Fettzellen: Sie stellen nach und nach ihre Funktion ein und sterben schließlich sogar ab. Andererseits nimmt die Zahl stark übergewichtiger Menschen weltweit immer weiter zu. „Weltweit suchen Arbeitsgruppen daher nach Wirkstoffen, die das braune Fett stimulieren und so die Fettverbrennung erhöhen“, sagt Pfeifer.
Sterbende Fettzellen kurbeln Verbrennung bei ihren Nachbarn an
Zusammen mit einer Gruppe von Kolleginnen und Kollegen hat nun das Team der Universität Bonn nun ein zentrales Molekül identifiziert, das dazu in der Lage ist. „Es ist bekannt, dass sterbende Zellen oft einen Mix aus Botenstoffen abgeben, die das Verhalten ihrer Nachbarn beeinflussen“, erläutert Dr. Birte Niemann aus Pfeifers Arbeitsgruppe. Zusammen mit ihrer Kollegin Dr. Saskia Haufs-Brusberg hat sie die zentralen Experimente der Studie geplant und durchgeführt. „Wir wollten wissen, ob das bei braunem Fett genauso ist.“
Die Forschenden untersuchten daher braune Fettzellen aus Mäusen, die sie stark gestresst hatten, so dass die Zellen quasi auf dem Weg in den Tod waren. „Dabei haben wir festgestellt, dass sie in großen Mengen ein Molekül namens Inosin ausschütten“, sagt Niemann. Interessanter war aber, wie intakte braune Fettzellen auf den molekularen Hilferuf reagierten: Sie wurden durch das Inosin (oder auch schlicht durch sterbende Zellen in ihrer Nähe) aktiviert. Der Signalstoff fachte also den Verbrennungsofen in ihnen an. Weiße Fettzellen wandelten sich zudem in ihre braunen Geschwister um. Mäuse, die sehr energiereiche Nahrung erhielten und gleichzeitig Inosin injiziert bekamen, blieben auch schlanker als ihre Artgenossen und waren vor Diabetes geschützt.
Eine wichtige Rolle scheint in diesem Zusammenhang der sogenannte Inosin-Transporter zu spielen: Dieses Protein in der Zellmembran transportiert Inosin in die Zelle und senkt so die Konzentration des Botenstoffs auf deren Außenseite. Das Signalmolekül kann so vermutlich nicht mehr seine verbrennungsfördernde Wirkung entfalten.
Medikament hemmt den Inosin-Transporter
„Es gibt ein Medikament, das eigentlich gegen Gerinnungsstörungen entwickelt wurde, aber auch den Inosin-Transporter hemmt“, sagt Pfeifer, der auch Mitglied in den Transdisziplinären Forschungsbereichen „Leben und Gesundheit“ und „Nachhaltige Zukunft“ sowie im Exzellenzcluster ImmunoSensation2 der Universität Bonn ist.
„Wir haben das Medikament Mäusen verabreicht, die daraufhin mehr Energie verbrauchten.“ Auch wir verfügen über einen Inosin-Transporter. Bei zwei bis vier Prozent aller Menschen ist er durch eine genetische Veränderung weniger aktiv. „Unsere Kollegen an der Universität Leipzig haben 900 Personen genetisch analysiert“, erklärt Pfeifer. „Diejenigen mit dem weniger aktiven Transporter waren im Schnitt deutlich schlanker.“
Die Ergebnisse deuten darauf hin, dass Inosin auch bei uns die Verbrennung in braunen Fettzellen reguliert. Substanzen, die in die Aktivität des Transporters eingreifen, könnten sich daher möglicherweise zur begleitenden Behandlung einer Fettleibigkeit (Adipositas) eignen. Als Ausgangspunkt könnte der bereits zugelassene Wirkstoff gegen Gerinnungsstörungen dienen. „Es sind aber weitere Studien in Menschen nötig, um das pharmakologische Potential dieses Mechanismus zu klären“, meint Pfeifer. Auch glaubt er nicht, dass eine Pille allein die Lösung für die weltweit grassierende Adipositas-Pandemie sein wird. „Die verfügbaren Therapien sind aber momentan zu wenig wirksam“, betont er. „Wir brauchen daher unbedingt Medikamente, um den Energiehaushalt in adipösen Patienten zu normalisieren.“
Welche Schlüsselrolle dabei der körpereigenen Heizung zuerkannt wird, zeigt sich auch in einem neuen Großprojekt: Die Deutsche Forschungsgemeinschaft (DFG) hat kürzlich einen Transregio-Sonderforschungsbereich bewilligt, in dem die Universitäten Bonn, Hamburg und München zielgerichtet an braunem Fettgewebe forschen.
Förderung:
An der Studie waren die Universität Bonn sowie das Universitätsklinikum Bonn, das Universitätsklinikum Hamburg-Eppendorf, die Universität sowie das Universitätsklinikum Leipzig, das Helmholtz-Zentrum München und die Universität Texas beteiligt. Die Arbeiten wurden durch die Deutsche Forschungsgemeinschaft sowie das National Institute of Health (USA) finanziert.
Publikation: Birte Niemann et al.: Apoptotic brown adipocytes enhance energy expenditure via extracellular inosine; Nature; https://doi.org/10.1038/s41586-022-05041-01