Pathogene Organismen existieren in verschiedenen Formen und nutzen unterschiedliche Strategien, um auf Kosten ihrer Wirte zu überleben und sich zu vermehren. Einige dieser Erreger werden als "biotroph" bezeichnet, da sie als Parasiten ihre Wirte am Leben erhalten. Diese biotrophen Pathogene deregulieren physiologische Prozesse in ihren Wirten, indem sie deren Immunabwehr unterdrücken und die Krankheitsentwicklung begünstigen. Bei biotrophen Pflanzenpathogenen werden solche „feindlichen Handlungen“ auch von Proteinen, die als Effektoren bezeichnet werden, durchgeführt. Der Maisbeulenbranderreger Ustilago maydis ist ein biotropher Pilz, welcher hunderte von Effektoren dafür einsetzt, seinen Wirt zu manipulieren. Bislang war das molekulare Waffenarsenal, mit dem Ustilago maydis die Maispflanze befällt, weitgehend unerforscht. Jetzt enthüllten Forscher um den Bonner Professor und früheren GMI-Gruppenleiter Armin Djamei die Funktion der Plejaden, einer heterogenen Gruppe von Effektorproteinen – und erzählen nebenbei eine Geschichte, die der griechischen Mythologie würdig ist.
Die Plejaden: Zwischen Mythologie, Sternen und Maisimmunität
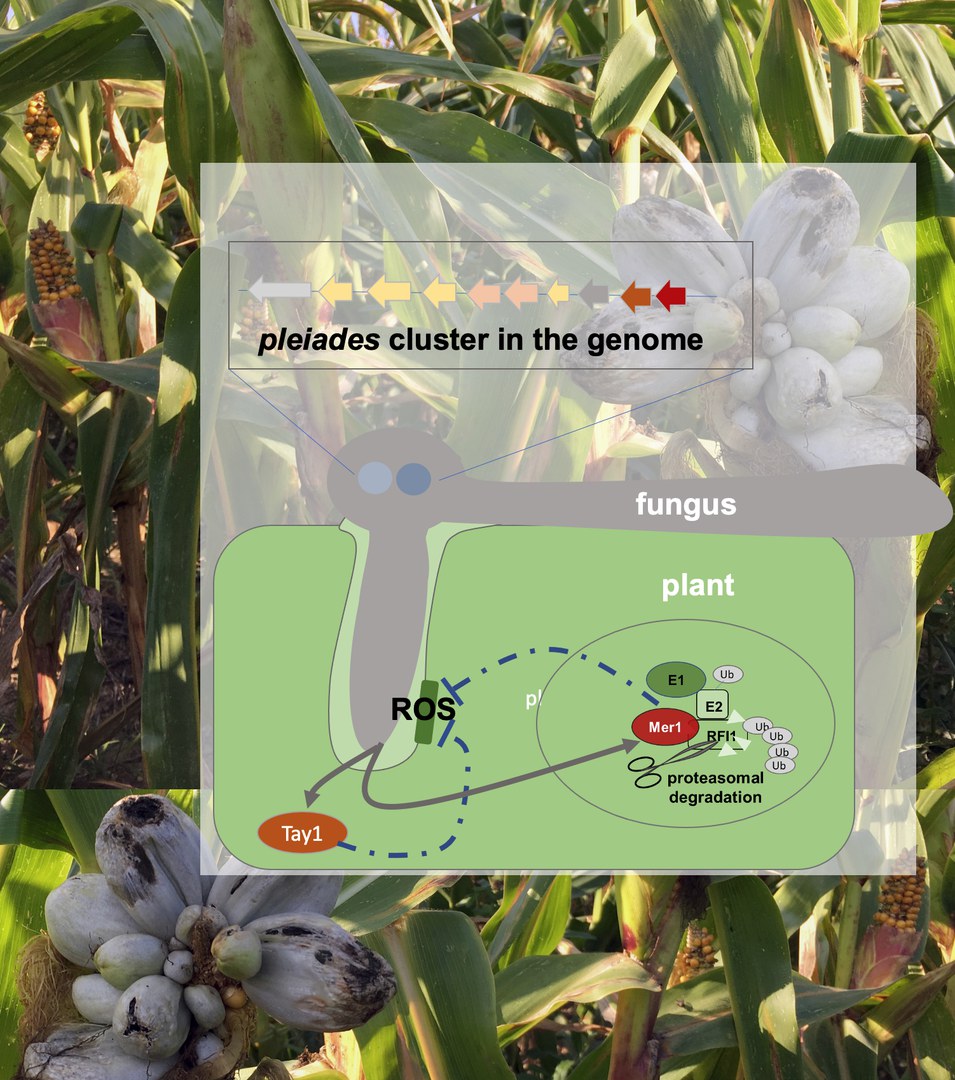
Ob der Sternhaufen im Sternbild Stier nach den sieben Töchtern von Atlas und Pleione benannt wurde, oder ob das Gegenteil der Fall ist, ist umstritten. Wie aber kommt eine Gruppe von Effektorproteinen im Maisbeulenbrand zu dem Namen Plejaden? Tatsächlich sind die Gene, die die Plejaden kodieren, als ko-regulierter Cluster im U. maydis-Genom angeordnet, daher die Analogie mit dem Sternhaufen. Außerdem ist der betreffende Gencluster, wie viele andere für Effektoren kodierenden Bereiche im Genom, besonders dynamisch. Dieses Phänomen ist zum Teil auf die hohe Prävalenz von Transposon-Sequenzen, also "springenden Genen", zurückzuführen. Die hohe Sequenzdiversität im genetischen Cluster der Plejaden hat zur Folge, dass Effektorproteine entstehen, denen konservierte Domänen fehlen. Daher ist eine sequenzbasierte Vorhersage der Funktionen der Plejaden nicht möglich. Die Kräfte, die im Kampf gegen die Maisimmunität im Spiel sind, warten noch weitestgehend auf eine genaue Untersuchung.
Unterschiedliche Taktiken führen zum gleichen Ziel
"Wir haben nun zum ersten Mal die Funktion eines ganzen Effektorclusters in U. maydis entschlüsselt, nämlich des Clusters von zehn Effektorgenen, die die Plejaden kodieren", sagt Prof. Dr. Armin Djamei vom Institut für Nutzpflanzenwissenschaften und Ressourcenschutz (INRES) der Universität Bonn. Dazu analysierte das Team den Effekt einer Deletion (Löschung) des Clusters im Erreger sowie die Produktion dieser Proteine in Pflanzen. "Wir konnten zeigen, dass eine Deletion des Clusters den Erreger stark schwächt und zur Anhäufung von Reaktiven Sauerstoff-Spezies, auf Englisch Reactive Oxygen Species, kurz ROS, in infiziertem Pflanzengewebe führt", erklärt Dr. Fernando Navarrete, Erstautor der Publikation.
Die schnelle Produktion von ROS ist ein bekannter pflanzlicher Immunabwehrmechanismus, der es der Pflanze ermöglicht, den eindringenden Erreger zu bekämpfen, aber auch benachbarte Zellen in Alarmbereitschaft versetzt. Acht der zehn Plejaden scheinen speziell auf diesen Mechanismus abzuzielen, wenn auch mit unterschiedlichen Mitteln und trotz deutlicher Sequenzunterschiede. Navarrete: "Unsere Ergebnisse unterstreichen die funktionelle Bedeutung von Effektorclustern bei Maisbrandpilzen. Die funktionelle Redundanz der einzelnen Akteure erklärt sich durch ihre mechanistische Vielfalt und Komplementarität. Man muss sich die einzelnen Plejaden als unterschiedliche Einheiten vorstellen, die denselben Feind an mehreren Fronten bekämpfen."
Blüte fördern, um Immunität besser zu bekämpfen?
Djamei und sein Team zeigten, dass zwei der Plejaden, Taygeta1 und Merope1, die ROS-Produktion in verschiedenen Teilen der Pflanzenzelle hemmen. Taygeta1 tut dies im Zytoplasma der Zelle, während Merope1 im Zellkern wirkt. Diese beiden “Schwestern" scheinen innerhalb der Plejaden die Führung im Kampf gegen die Pflanzenimmunität zu übernehmen, indem sie neue Rollen besetzen. Die Forscher entdeckten für Merope1 des Weiteren den genauen Wirkmechanismus: Diese Plejade scheint eine Familie von Enzymen zu beeinflussen, die auch die Blütezeit kontrollieren. "Ein Effektor, der die Immunität dämpft und gleichzeitig die Blüte fördert, wäre ein großer Vorteil für Brandpilze, die sich normalerweise nur im Blütengewebe des Wirts sexuell vermehren", erklärt Djamei.
In der griechischen Mythologie ist Merope übrigens die einzige Plejade, die bei der Heirat mit einem Sterblichen verblasst, während ihre Schwestern ihr ewiges Leuchten bewahren. In Kunstwerken des 19. Jahrhunderts wurde sie oft als “verlorene Plejade” dargestellt – nun ist sie in der Bekämpfung der Pflanzenimmunität wieder aufgetaucht.
Beteiligte Institutionen und Förderung:
Der Großteil dieser Forschung wurde am GMI durchgeführt. Finalisiert wurde die Arbeit am Leibniz-Institut für Pflanzengenetik und Kulturpflanzenforschung (IPK), Gatersleben, Stadt Seeland, Deutschland und der Universität Bonn, INRES, Abteilung für Pflanzenpathologie. Armin Djamei ist Mitglied des Exzellenzclusters „PhenoRob - Robotics and Phenotyping for Sustainable Crop Production” der Universität Bonn, das die Studie auch förderte. Darüber hinaus wurde die Arbeit durch den Europäischen Forschungsrat, die Deutsche Forschungsgemeinschaft, den Fonds zur Förderung der wissenschaftlichen Forschung in Österreich und die Österreichische Akademie der Wissenschaften gefördert.
Publikation: Navarrete F. et al.: "The Pleiades are a cluster of fungal effectors that inhibit host defenses". PLOS Pathogens, https://doi.org/10.1371/journal.ppat.1009641