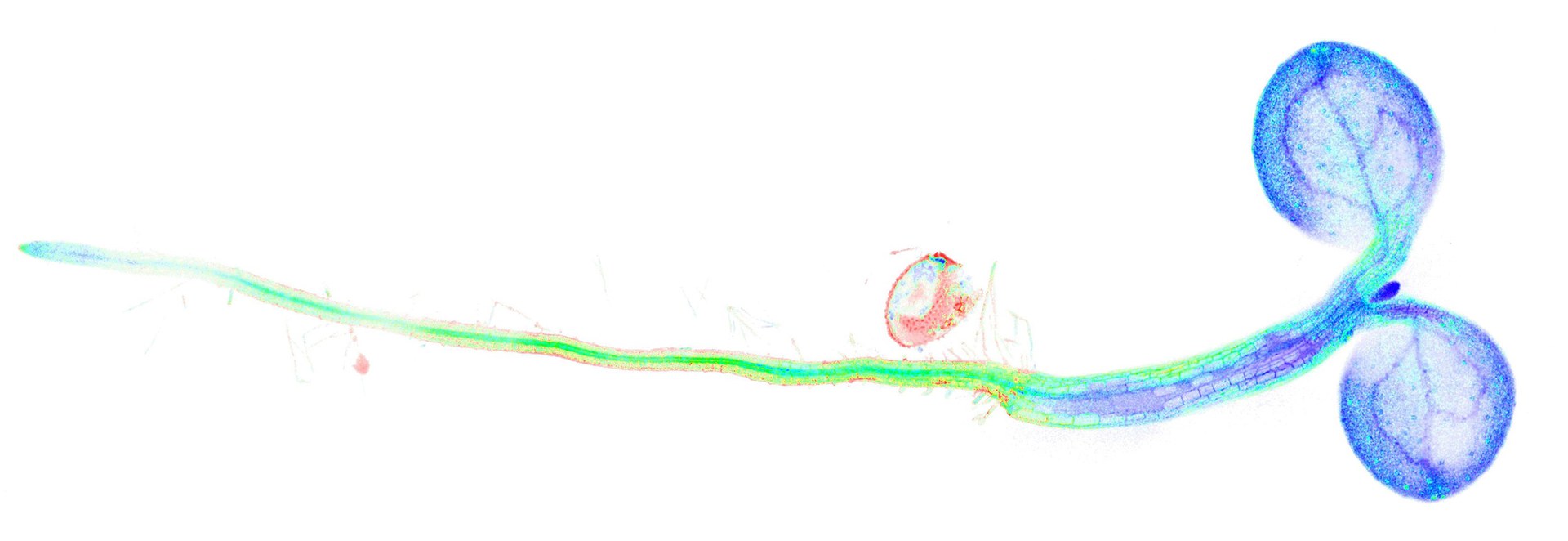
Vom Stoffwechsel in Pflanzen hängt nicht nur fast alles Leben auf der Erde, sondern hängen insbesondere auch unsere Ernährung und unsere Gesundheit ab. Um zu verstehen, wie diese Stoffwechselprozesse in Pflanzen funktionieren, untersuchen Wissenschaftler des Instituts für Biologie und Biotechnologie der Pflanzen der Westfälischen Wilhelms-Universität Münster (WWU) unter Beteiligung der Universität Bonn Schlüsselmechanismen der Regulation des Energiestoffwechsels. Ein neues Verfahren der in vivo Biosensorik erlaubt es ihnen nun erstmals in Echtzeit zu verfolgen, wie sich Umweltveränderungen, zum Beispiel Licht, Temperatur, Trockenheit, Überflutung oder Schädlingsbefall, auf den zentralen Stoffwechsel in der Modellpflanze Arabidopsis thaliana, der Ackerschmalwand, auswirken.
Hintergrund und Methodik
Das Forscherteam hat einen genetisch-codierten Sensor in die Pflanzen eingebaut, um zentrale Stoffwechselprozesse im wahrsten Sinne des Wortes ‚sichtbar‘ zu machen. „Da Pflanzen äußerlich sehr statisch wirken, müssen sie innerhalb ihrer Zellen Meister der Flexibilität und Anpassung sein und zwar blitzschnell. Diese Dynamik können wir nun live in der lebenden Pflanze beobachten“, sagt Dr. Janina Steinbeck, Erstautorin der Studie. Für die bildliche Darstellung und Messung des Stoffwechselprozesses in der Pflanze nutzten die Forscher die in vivo Biosensorik, ein Verfahren, das in Echtzeit lebende Organismen, Gewebe oder Zellen untersucht. Der Biosensor besteht aus einem biologischen Erkennungselement, einem Protein, das ein zu detektierendes Molekül spezifisch bindet, und einem Ausleseelement, einem Protein, das die Bindung am Erkennungselement in ein Lichtsignal übersetzt. Ursprünglich wurde der nun verwendete Biosensor für den Einsatz in Nervenzellen entwickelt. Die Wissenschaftler haben diesen Sensor verfeinert und für den Einsatz in der Pflanze weiterentwickelt.
Der Sensor kann die Moleküle NAD+ und NADH direkt binden und wieder abgeben. Das sogenannte NAD-Redox-System ist für die Elektronenübertragung im Stoffwechsel fast aller Lebewesen von zentraler Bedeutung. Der Sensor besteht aus einem blaugrün und einem rot fluoreszierenden Protein, die je nach NAD Status in der Zelle ihre Helligkeit ändern. Das Auslesen der Sensoren in lebenden Zellen erfolgt über ein modernes konfokales Laser-Scanning Mikroskop. Die Möglichkeit des NAD in vivo Sensings in Pflanzen öffnet den Pflanzenforschern neue Türen: „Für uns ist dieses neue Verfahren eine methodische Errungenschaft, denn wir erhalten erstmals ein direktes Verständnis von Stoffwechselprozessen exakt dort, wo sie in der Zelle passieren. Beispielsweise kam die Beobachtung, dass sich ein so zentraler Prozess wie der NAD-Stoffwechsel bei der Immunreaktion tiefgreifend verändert, für uns völlig unerwartet“, erläutert Prof. Dr. Markus Schwarzländer, Leiter der Arbeitsgruppe Plant Energy Biology der WWU.
Bislang war es lediglich möglich, diese Art von Stoffwechselprozessen zu untersuchen, indem die Wissenschaftler Extrakte von den Pflanzen gewonnen haben, um sie mit biochemischen Methoden zu analysieren. Hierbei werden jedoch Zellen und Gewebe zerstört und es ist nicht mehr nachvollziehbar, wo genau sich die Stoffwechselveränderungen vollzogen haben. Jetzt können die Forscher dynamische Änderungen des Redoxstoffwechsels, der unter anderem der Energiebereitstellung in den Zellen dient, von spezifischen Zellkompartimenten, hier im Zytosol, in den einzelnen Zellen bis hin zu ganzen Organen von intakt lebenden Pflanzen verfolgen.
„Die intakte Zelle selbst wird damit zum Testobjekt für die Visualisierung von Lebensprozessen. Wir können so die Physiologie der Zelle live beobachten und damit Lebenswissenschaften im wahrsten Sinne des Wortes betreiben“, erklärt Prof. Dr. Andreas Meyer, Leiter der Arbeitsgruppe Chemical Signalling am Institut für Nutzpflanzenwissenschaft und Ressourcenschutz (INRES) der Universität Bonn.
Dieses Vorgehen ermöglichte es, eine erste NAD-Redox-Landkarte der ganzen Pflanze zu erstellen sowie Redox-Dynamiken bei Licht-Dunkel-Übergängen, Veränderungen des Zuckerstatus, der Zellatmung und der Sauerstoffzufuhr zu beobachten. „Hierdurch wird die direkte Verknüpfung zwischen Stoffwechsel und Umwelt aufgezeigt. Besonders spannend war dabei die neue Verbindung zur Immunantwort, von der wir bisher nur wenig Ahnung hatten und die es nun weiter zu untersuchen gilt“, sagt Markus Schwarzländer.
Fast zeitgleich mit der Veröffentlichung in The Plant Cell erschien auch eine Studie von Forschern in Hong Kong in der Zeitschrift Nature Communications. Dort wurde ein anderer Sensor für NAD in Pflanzen eingebaut und zur Untersuchung der Photosynthese verwendet. Die Ergebnisse der beiden Studien stützen sich gegenseitig. „Die Informationen, die durch das neue Verfahren gewonnen werden, können zukünftig eine Schlüsselrolle bei der Züchtung von Pflanzen, die unsere Nahrungsmittelerzeugung nachhaltiger machen und dazu beitragen die Effekte des Klimawandels abzumildern, spielen. Aber auch die direkte Früherkennung von Stress bei Nutzpflanzen in der Landwirtschaft ist möglich“, fasst Markus Schwarzländer die Ergebnisse ausblickend zusammen.
Beteiligte Institutionen und Förderung:
An der Studie waren neben der WWU die Universitäten Bonn, Oxford in England, Padua in Italien, Viçosa in Brasilien und Saarbrücken beteiligt. Die Studie erhielt finanzielle Unterstützung durch die Deutsche Forschungsgemeinschaft (DFG).
Publikation: Steinbeck, J., et al. (2020): In vivo NADH/NAD+ biosensing reveals the dynamics of plant cytosolic redox metabolism, The Plant Cell, DOI: 10.1105/tpc.20.00241
Kontakt für die Medien:
Prof. Dr. Markus Schwarzländer
Plant Energy Biology
Universität Münster
Tel. +49-(0)251-8324801
E-Mail: markus.schwarzlander@uni-muenster.de
Prof. Dr. Andreas Meyer
Chemical Signalling
Institut für Nutzpflanzenwissenschaft und Ressourcenschutz (INRES)
Universität Bonn
Tel. +49-(0)228-7360353
E-Mail: andreas.meyer@uni-bonn.de