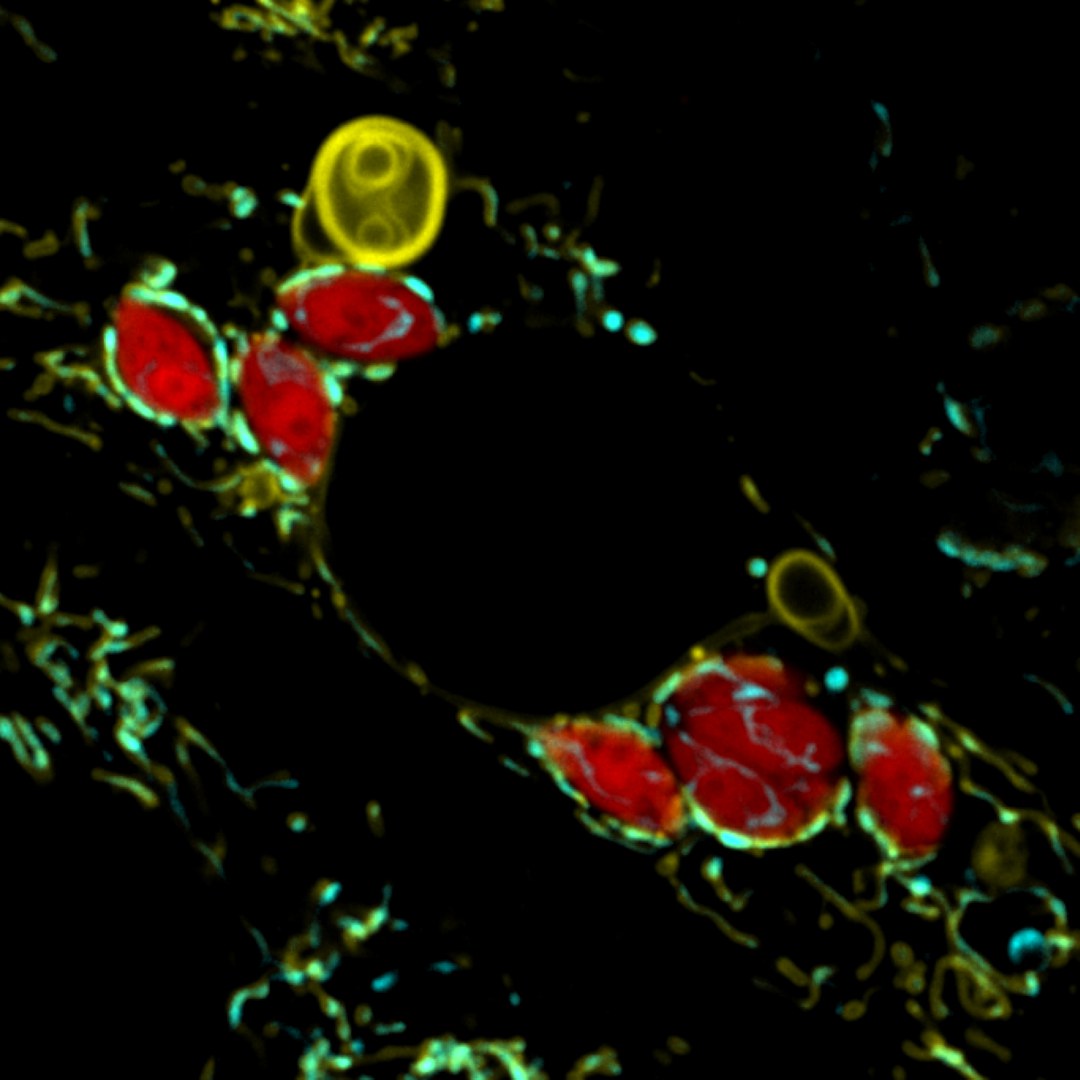
Um zu überleben, müssen Krankheitserreger die Abwehrmechanismen des Wirts ausschalten. Einer dieser Abwehrmechanismen kommt von den Mitochondrien in der Zelle des Wirts, die den Erregern die benötigten Nährstoffe entziehen und so ihr Wachstum einschränken. „Wir wollten wissen, wie sich das Verhalten der Mitochondrien sonst noch verändert, wenn Mitochondrien und Krankheitserreger in der Zelle aufeinandertreffen. Da die äußere Membran dieser Organellen der erste Kontaktpunkt mit den Eindringlingen ist, haben wir uns diese genauer angeschaut“, sagt Studienleiterin Dr. Lena Pernas vom Max-Planck-Institut für Biologie des Alterns.
Mitochondrien stoßen ihre „Haut“ ab
Die Forschenden infizierten Zellen mit dem menschlichen Parasiten namens Toxoplasma gondii und beobachteten live unter dem Mikroskop, was mit der äußeren Membran der Mitochondrien passiert. „Wir sahen, dass Mitochondrien, die mit dem Parasiten in Kontakt kamen, große Strukturen von ihrer äußeren Membran ablösten. Das war für uns sehr rätselhaft. Warum sollten Mitochondrien das abstoßen, was im Grunde das Bindeglied zwischen ihnen und dem Rest der Zelle ist?“, sagt Xianhe Li, Erstautor der Studie.
Feindliche Übernahme
Aber wie bringt der Parasit die Mitochondrien dazu, das zu tun? Das Forschungsteam konnte zeigen, dass der Erreger über ein Protein verfügt, das ein mitochondriales Wirtsprotein nachahmt. Es bindet an einen Rezeptor auf der äußeren Membran der Mitochondrien, um Zugang zu der Maschinerie zu erhalten, die dafür sorgt, dass Proteine in Mitochondrien importiert werden. „Auf diese Weise kapert der Parasit eine normale Reaktion des Wirts auf mitochondrialen Stress. Dies führt zu einer Entwaffnung der Mitochondrien“, sagt Pernas.
In einer Kooperation im Sonderforschungsbereich 1218 „Mitochondrial regulation of cellular function“ untersuchten Prof. Dr. Thomas Becker und Dr. Fabian den Brave vom Institut für Biochemie und Molekularbiologie der Universität Bonn, welchen Einfluss das parasitäre Protein auf die Aufnahme von Proteinen in die Mitochondrien hat. „Wir fanden mithilfe des Modelorganismus Bäckerhefe heraus, dass die Anbindung des Proteins an den Rezeptor die Proteinaufnahme in die Mitochondrien beeinträchtigt“, sagt Thomas Becker, Mitglied im Transdisziplinären Forschungsbereich „Life and Health“ der Universität Bonn.
„Andere Forschende haben gezeigt, dass ein Protein des SARS-CoV-2-Virus ebenfalls an diesen Transportrezeptor bindet, was darauf hindeutet, dass der Rezeptor eine wichtige Rolle bei der Interaktion zwischen Wirt und Krankheitserreger spielt“, sagt Pernas. Laut den Forschenden sind jedoch weitere Untersuchungen erforderlich, um seine Rolle bei verschiedenen Infektionen besser zu verstehen.
Publikation:
Xianhe Li, Julian Straub, Tânia Catarina Medeiros, Chahat Mehra, Fabian den Brave, Esra Peker, Ilian Atanassov, Katharina Stillger, Jonas Benjamin Michaelis, Emma Burbridge, Colin Adrain, Christian Münch, Jan Riemer, Thomas Becker, Lena F. Pernas: Mitochondria shed their outer membrane in response to infection-induced stress. Science; DOI: 10.1126/science.abi4343