Bei der altersabhängigen Makuladegeneration (AMD) geht die Sehschärfe im Zentrum des Blickfeldes zunehmend verloren – Autofahren, Zeitung lesen oder das Erkennen von Gesichtern wird damit unmöglich. Trotz Durchbrüchen bei der Therapie der feuchten Form der Erkrankung lässt sich die häufige trockene Form weiterhin nicht behandeln. Bei der AMD erkranken zunächst die retinalen Pigmentepithelzellen (RPE). Sie liegen unter den Sehzellen und sind für deren Ernährung und die Entsorgung ihrer Stoffwechselabfälle zuständig. Im Zuge der fortschreitenden Erkrankung werden die Pigmentepithelzellen zunehmend geschädigt, wodurch in der Folge auch die Sehzellen zugrunde gehen.
An der Krankheit sind Entzündungsreaktionen des angeborenen Immunsystems, oxidativer Stress und eine zunehmende Ansammlung von Stoffwechselmüll in der Netzhaut beteiligt. „Inzwischen sind viele Teilaspekte der Krankheitsentstehung durch wissenschaftliche Studien identifiziert, doch das Zusammenspiel dieser Faktoren lag bislang weitgehend im Dunkeln“, sagt Privatdozent Dr. med. Tim U. Krohne von der Universitäts-Augenklinik Bonn, der die Studie leitete. Zusammen mit Prof. Dr. Eicke Latz vom Institut für Angeborene Immunität des Universitätsklinikums Bonn haben Wissenschaftler um Dr. Krohne nun entschlüsselt, wie bei der Makuladegeneration die verschiedenen Prozesse zusammenwirken können.
Komplementkomponente C5a aktiviert Entzündungprozesse im RPE
Das von der Deutschen Forschungsgemeinschaft (DFG) geförderte Forscherteam kultivierte menschliche RPE-Zellen im Labor und fütterte sie mit Substanzen, die wie bei der AMD zu einer Anreicherung mit dem schädlichen Alterspigment Lipofuszin führten. Anschließend bestrahlten die Wissenschaftler die Zellen mit Licht, wodurch es wie bei der Augenerkrankung zu einer oxidativen Schädigung des RPE kam. Die Oxidantien in den Zellen bewirkten, dass das Inflammasom als Bestandteil des angeborenen Immunsystems aktiviert wurde. „Hierbei spielt die Komplementkomponente C5a eine wichtige Rolle, die sich bei der AMD im Bereich der Pigmentepithelzellen anhäuft“, berichtet Erstautorin Carolina Brandstetter aus Dr. Krohnes Arbeitsgruppe. Die Aktivierung des Inflammasoms führte dazu, dass die betroffenen RPE-Zellen Schaden nahmen und schließlich sogar abstarben.
Ansatzpunkt für neuartige Therapien
Die Wissenschaftler hoffen nun, dass ihre grundlegenden Erkenntnisse zum Zusammenspiel der beteiligten Mechanismen zu neuen Therapieansätzen für die Behandlung der AMD führen. „Ein Ansatzpunkt könnte sein, das Inflammasom oder das Komplementsystem des Immunsystems zu blockieren, um ein Fortschreiten der Erkrankung zu stoppen“, sagt Dr. Krohne. Vielversprechende Wirkstoffe würden derzeit von verschiedenen Forschergruppen getestet. Bis zu einer Therapie seien jedoch noch viele Schritte notwendig. „Mit dem Einblick in die zugrundeliegenden Mechanismen und darauf aufbauenden gezielten Behandlungsansätzen besteht die Hoffnung, zukünftig Erblindung durch die Makuladegeneration zu verhindern, sagt Prof. Dr. Frank G. Holz, Direktor der Augenklinik.
Publikation: Complement component C5A primes retinal pigment epithelial cells for inflammasome activation by lipofuscin-mediated photooxidative damage, „The Journal of Biological Chemistry“, DOI: 10.1074/jbc.M115.671180; Internet: http://www.jbc.org/content/early/2015/11/12/jbc.M115.671180.abstract1
Kontakt für die Medien:
Privatdozent Dr. med. Tim U. Krohne
Universitäts-Augenklinik Bonn
Tel. 0228/28715505
E-Mail: krohne@uni-bonn.de
Forschung zur häufigsten Erblindungsursache Forschung zur häufigsten Erblindungsursache
Uniklinikum Bonn entdeckt Zusammenhang zwischen Schlüsselfaktoren der altersabhängigen Makuladegeneration
Die altersabhängige Makuladegeneration (AMD) ist in den Industrienationen die häufigste Erblindungsursache. Ein Forscherteam aus Augenärzten und Immunologen des Bonner Universitätsklinikums hat nun einen gemeinsamen Mechanismus verschiedener an der Krankheit beteiligter Prozesse entschlüsselt. Die Ergebnisse aus der Grundlagenforschung bieten auch Ansatzpunkte für neuartige Therapien. Nun ist die Studie im „Journal of Biological Chemistry“ veröffentlicht.

Am Zellkulturmikroskop:
- Diplom-Biologin Carolina Brandstetter und Privatdozent Dr. med. Tim U. Krohne von der Universitäts-Augenklinik Bonn.
© Foto: Katharina Wislsperger/UKB
Alle Bilder in Originalgröße herunterladen
Der Abdruck im Zusammenhang mit der Nachricht ist kostenlos, dabei ist der angegebene Bildautor zu nennen.
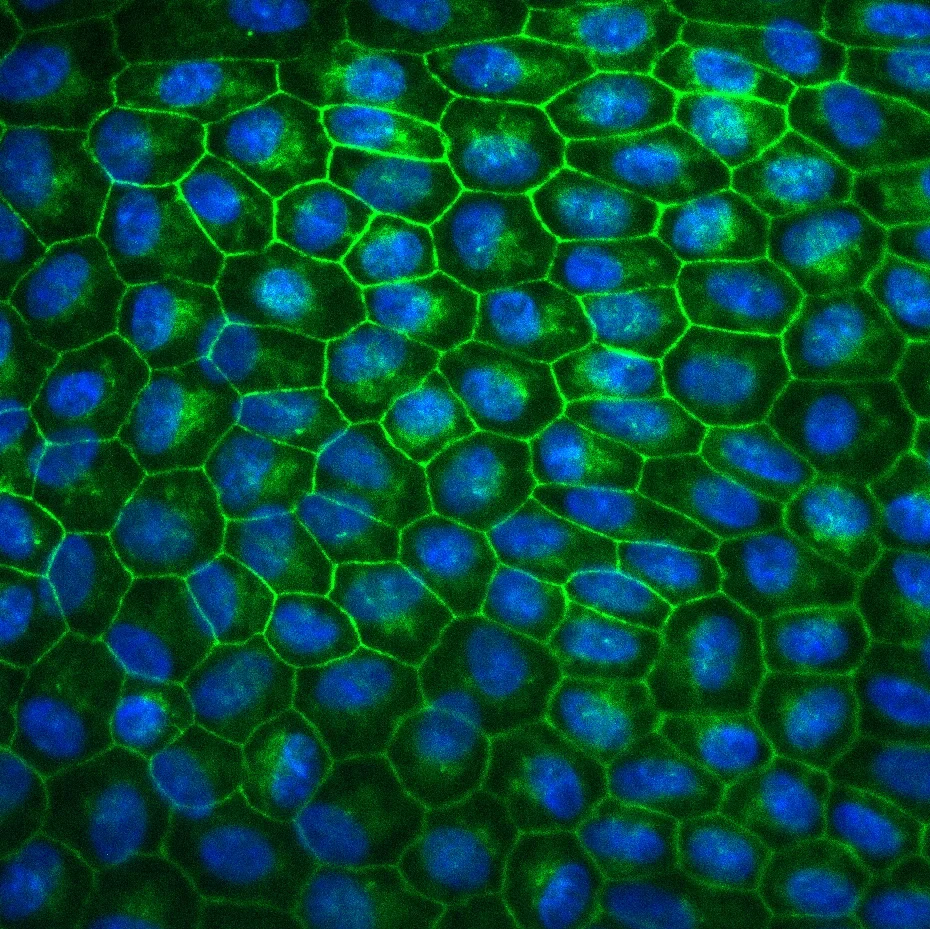
Fluoreszenzmikroskopische Aufnahme
- menschlicher Netzhautzellen (retinale Pigmentepithelzellen): Grün dargestellt sind die Zellgrenzen, blau die Zellkerne.
© Foto: Carolina Brandstetter/UKB
Links
- http://www.jbc.org/content/early/2015/11/12/jbc.M115.671180.abstract
- https://www.uni-bonn.de/de/universitaet/presse-kommunikation/presseservice/archiv-pressemitteilungen/2015/291-2015
- https://www.uni-bonn.de/de/universitaet/presse-kommunikation/presseservice/archiv-pressemitteilungen/2015/293-2015


