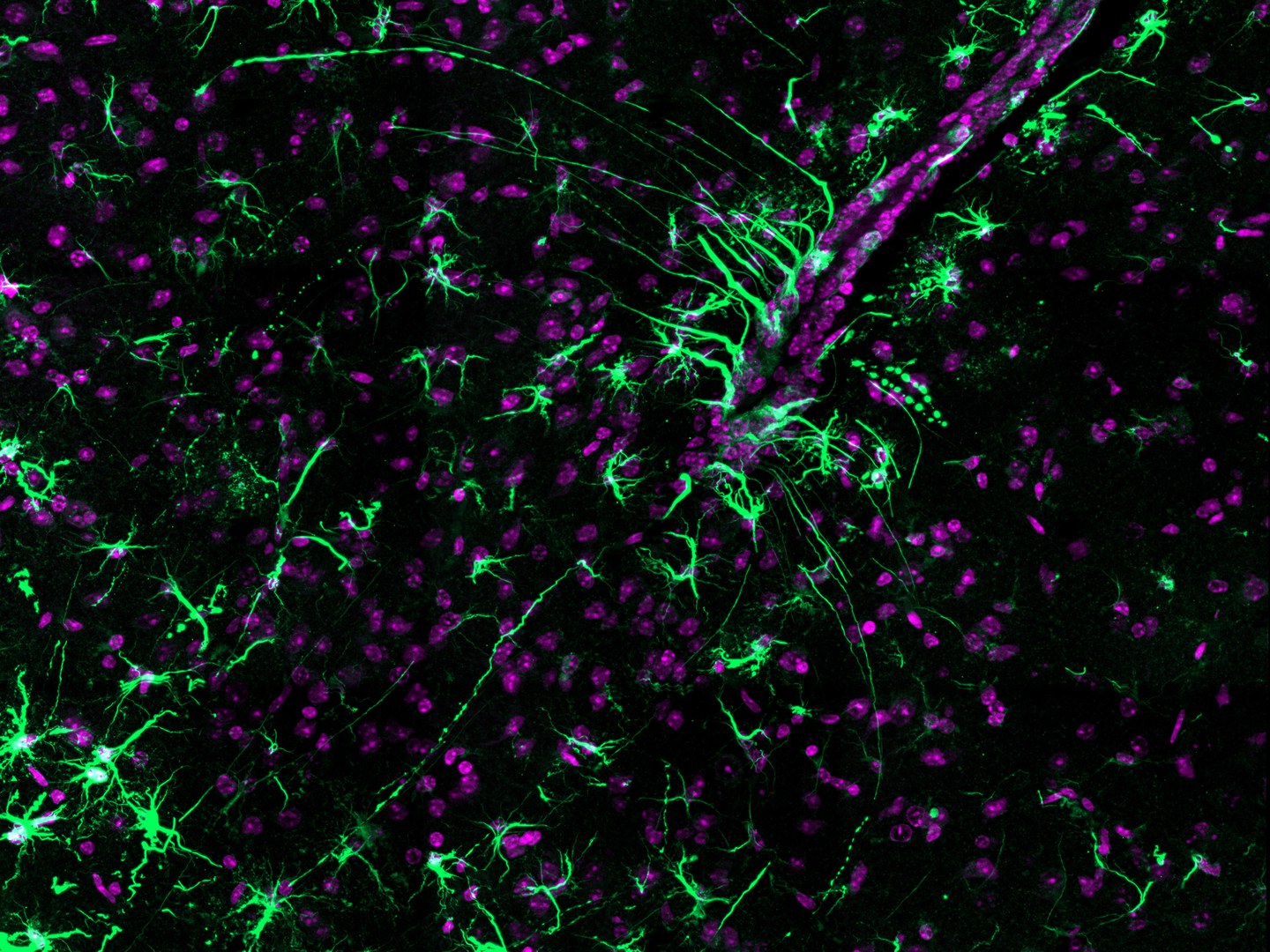
Die Forscher untersuchten das Gehirn von fettleibigen und normalgewichtigen Mäusen. Dabei konzentrierten sie sich auf den Hypothalamus, eine wichtige Steuerzentrale des Nervensystems. Der Hypothalamus passt unter anderem das Energieangebot im Körper an die Nachfrage an, indem er den Appetit und damit die Nahrungsaufnahme reguliert.
„Es ist bekannt, dass der Hypothalamus auf Fettsäuren im Blut reagiert“, erklärt Dr. Lars Kürschner vom LIMES-Institut der Universität Bonn. „So drosselt er die Nahrungsaufnahme, wenn sich nach einer Mahlzeit der Fettsäurespiegel erhöht.“ Doch wo genau der Fettsäure-Sensor sitzt und wie er funktioniert, ist noch weitgehend unerforscht.
Kürschners Arbeitsgruppe versucht, diese Frage zu beantworten. Dazu hat sie in den letzten drei Jahren untersucht, wie der Hypothalamus Fettsäuren (fachsprachlich: Lipide) verarbeitet. „Wir wollten unter anderem wissen, welche Zellen in dieser Hirnregion daran beteiligt sind“, erklärt Kürschner.
In der aktuellen Studie konnte das Team zeigen, dass es mindestens zwei Zelltypen sind, die bei diesem Vorgang eine Schlüsselrolle einnehmen: die Astrozyten und die Tanyzyten. Beide zählen zu den so genannten Gliazellen. Diese verdanken ihren Namen der Funktion, die man ihnen früher zuschrieb: Bis vor einigen Jahrzehnten galten sie als reines Stützgewebe, das die empfindlichen Nervenzellen schützt („Glia“ heißt soviel wie „Kitt“ oder „Leim“).
Heute weiß man, dass die Gliazellen weit wichtigere und vielfältigere Aufgaben übernehmen als ursprünglich angenommen. So scheinen sie auch eine wichtige Rolle bei der Lipid-Erkennung und -Verarbeitung im Gehirn zu spielen. „Unsere Ergebnisse belegen, dass Astrozyten und Tanyzyten zusammen die Aufnahme und Verarbeitung der Fettsäuren innerhalb des Hypothalamus organisieren“, betont Kürschner.
Fett-Sensorik bei übergewichtigen Mäusen verändert
Die Tanyzyten sitzen am Rand des Hypothalamus. Sie sind an der Aufnahme der Lipide in den Hypothalamus beteiligt und entscheiden dann, was mit ihnen weiter geschieht. Im Normalfall geben sie diese selektiv an die angrenzenden Astrozyten weiter. Dort werden die Lipide zum Beispiel in die Membranen eingebaut, die die Astrozyten umgeben, oder dienen der zellulären Energiegewinnung.
Bei krankhafter Fettleibigkeit (Adipositas) ist der Fettsäurespiegel dauerhaft erhöht. „Auch bei übergewichtigen Tieren kommen die Fettsäuren zunächst bei den Tanyzyten an“, erklärt Dr. Kürschner. „Die ungesättigten Fettsäuren werden jedoch kaum noch weitergereicht. Die Restmengen werden von den Astrozyten dann vornehmlich zu Energie umgesetzt und nicht für den Aufbau von Membranen verwendet. Ein beträchtlicher Anteil aller Fettsäuren verlässt aber gar nicht erst die Tanyzyten, sondern wird dort in Form von Lipid-Tröpfchen eingelagert.“
Bei krankhafter Fettleibigkeit verändert also der Tanyzyt seine Durchlässigkeit für Lipide, und der Astrozyt verwendet diese zusätzlich anders. Möglicherweise tragen diese Anpassungen zu der hohen Kalorienaufnahme bei, die bei krankhaftem Übergewicht zu beobachten ist. „Allerdings können wir keine Aussagen darüber machen, ob sich diese Prozesse unmittelbar auf das Verhalten auswirken“, sagt Kürschner.
Die aktuellen Ergebnisse deuten aber darauf hin, dass es bei Adipositas zu Veränderungen an der Schaltzentrale zur Stoffwechselkontrolle kommt. „Wir wollen nun klären, welchen Einfluss zum Beispiel das Fasten auf die von uns identifizierten biologischen Prozesse hat“, erklärt Kürschner. „Da beim Fasten die Fettreserven im Körper mobilisiert werden, ist auch in diesem Fall der Fettsäurespiegel im Blut erhöht. Uns interessiert, wie der Körper zwischen Adipositas und längerem Hungern unterscheidet.“
Publikation: Kristina Hofmann, Christian Lamberz, Kira Piotrowitz, Nina Offermann, Diana But, Anja Scheller, Ashraf Al-Amoudi, Lars Kuerschner: Tanycytes and a differential fatty acid metabolism in the hypothalamus. Glia 2016. DOI: 10.1002/glia.23088
Kontakt:
Dr. Lars Kürschner
LIMES-Institut der Universität Bonn
Telefon: 0228/73-62816,
E-Mail: kuerschn@uni-bonn.de