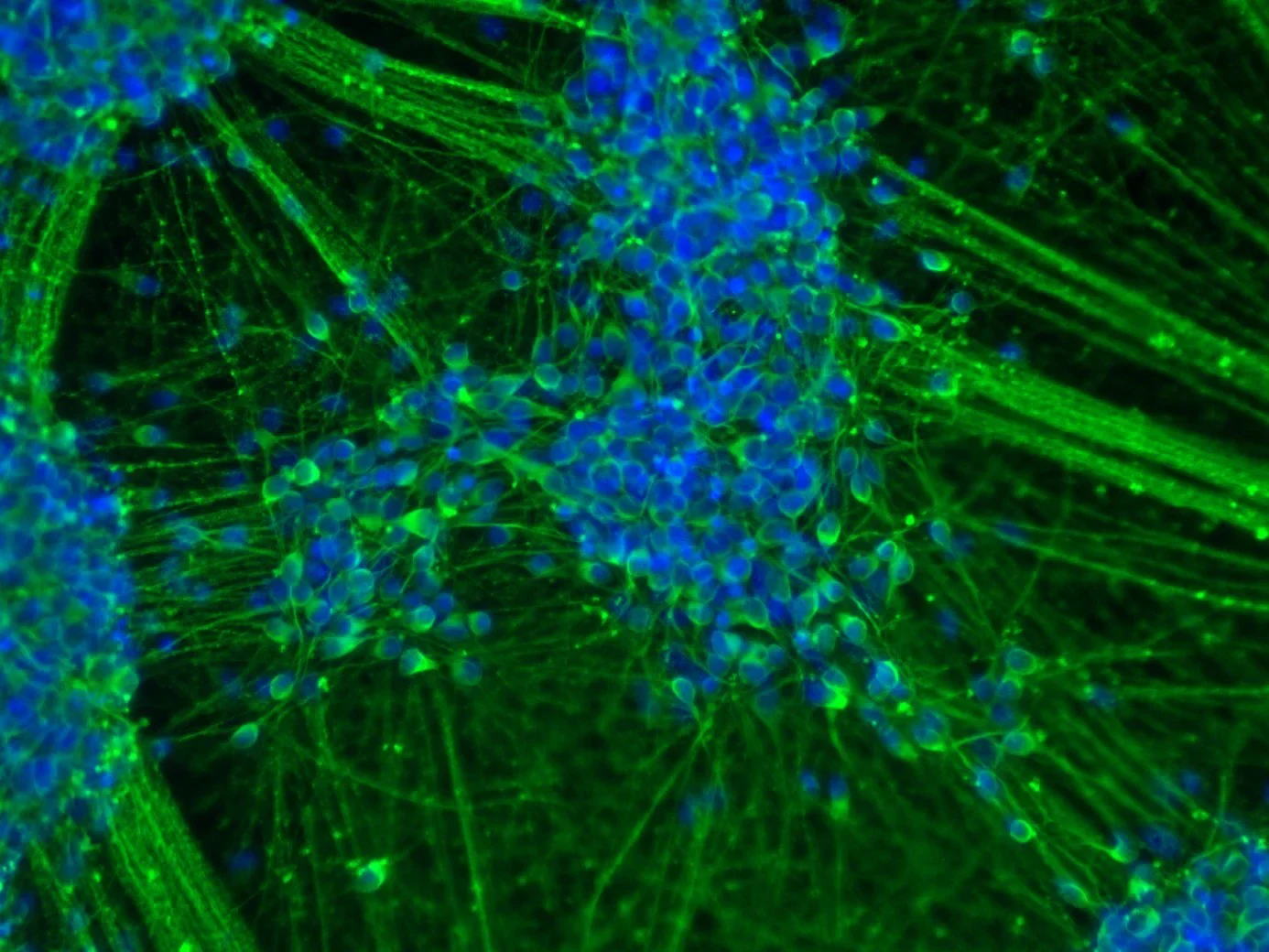
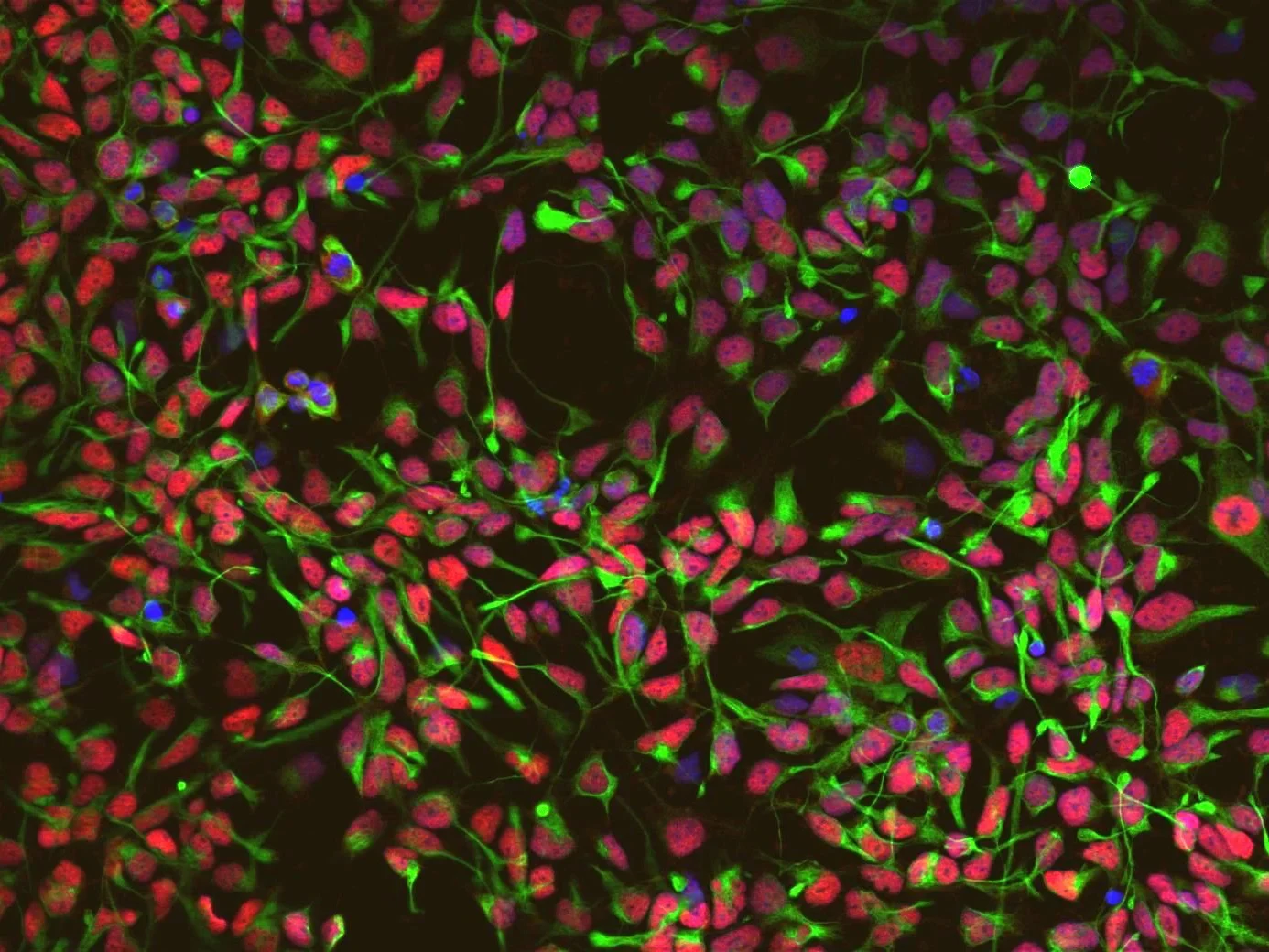
Als Ausgangsstoff dienten den Wissenschaftlern ganz normale weiße Blutkörperchen. Diese hatten sie zuvor erwachsenen Spendern unterschiedlichen Alters entnommen. In die Zellen schleusten sie zwei so genannte Transkriptionsfaktoren ein; das sind Proteine, die selektiv die Aktivität bestimmter Gene steuern. Dadurch gelang es ihnen, die Blutkörperchen zu neuralen Stammzellen umzuprogrammieren. Aus diesen wiederum konnten sie dann sowohl Nerven- als auch unterschiedliche Arten von Gliazellen züchten – also die Gewebetypen, die den Großteil des menschlichen Gehirns ausmachen.
Die eingeschleusten Transkriptionsfaktoren sind nicht stabil und gehen später wieder verloren. „Wir haben also Blut- in Gehirnzellen umgewandelt, ohne sie genetisch in irgendeiner Form zu verändern“, betont Dr. Michael Peitz vom Institut für Rekonstruktive Neurobiologie der Universität Bonn und der gemeinsam mit dem DZNE betriebenen Zellprogrammierungs-Plattform. Interessanterweise ging mit dieser Verwandlung auch eine Verjüngung einher. In Zellen werden manche Gene im Laufe ihrer Alterung mit einem chemischen Etikett versehen und dadurch hoch- oder heruntergefahren. Alte Zellen haben daher ein charakteristisches Genaktivitätsmuster, das sich von dem junger Zellen unterscheidet.
„Fitte“ Zellen für den Gewebeersatz
„Bei unserer Reprogrammierung wurde die altersbedingte Etikettierung nahezu vollständig rückgängig gemacht“, sagt Prof. Dr. Oliver Brüstle, Direktor des Instituts für Rekonstruktive Neurobiologie am LIFE & BRAIN Center. „Die Stammzellen unterschieden sich daher in ihrer Genaktivität und ihrer Funktion kaum von denen eines Neugeborenen.“ Diese „jugendlich-fitten“ Zellen eignen sich vermutlich besonders gut für Gewebeersatz-Therapien.
Dass sich aus weißen Blutkörperchen Hirnzellen züchten lassen, ist keine neue Erkenntnis. Allerdings geht man dazu bislang einen anderen Weg: Man stellt aus dem Blut zunächst so genannte induzierte pluripotente Stammzellen (iPS-Zellen) her, die sich in die unterschiedlichsten Gewebetypen entwickeln können. In einem zweiten Schritt erfolgt dann die Umwandlung dieser zellulären Tausendsassa in neurale Stammzellen. „Insgesamt kann dieser Prozess vier Monate und mehr in Anspruch nehmen“, erklärt Peitz. Die neue Methode geht gewissermaßen eine Abkürzung, ohne den Zwischenschritt über die iPS-Zellen. Sie benötigt daher nur gut zwei Wochen.
Ein Fortschritt, der auch die Erforschung bestimmter Hirnkrankheiten deutlich erleichtern dürfte: Die Forscher nutzten ihr Verfahren bereits, um aus den Blutzellen von Patienten mit einer seltenen angeborenen neurologischen Störung Hirngewebe zu züchten. Solche Zellkulturen erlauben einen detaillierteren Einblick in die Krankheitsmechanismen. Dieser wiederum ist eine wesentliche Voraussetzung für die Entwicklung neuer Behandlungsansätze.
Publikation: Chao Sheng, Johannes Jungverdorben, Hendrik Wiethoff, Qiong Lin, Lea J. Flitsch, Daniela Eckert, Matthias Hebisch, Julia Fischer, Jaideep Kesavan, Beatrice Weykopf, Linda Schneider, Dominik Holtkamp, Heinz Beck, Andreas Till, Ullrich Wüllner, Michael J. Ziller, Wolfgang Wagner, Michael Peitz und Oliver Brüstle: A stably self-renewing adult blood-derived induced neural stem cell exhibiting patternability and epigenetic rejuvenation; Nature Communications; DOI: 10.1038/s41467-018-06398-5
Kontakt für die Medien:
Prof. Dr. Oliver Brüstle
Institut für Rekonstruktive Neurobiologie
Universitätsklinikum Bonn
Tel. 0228/6885-500
Dr. Michael Peitz
Institut für Rekonstruktive Neurobiologie
Universitätsklinikum Bonn
Tel. 0228/6885-156
E-Mail: peitz@uni-bonn.de