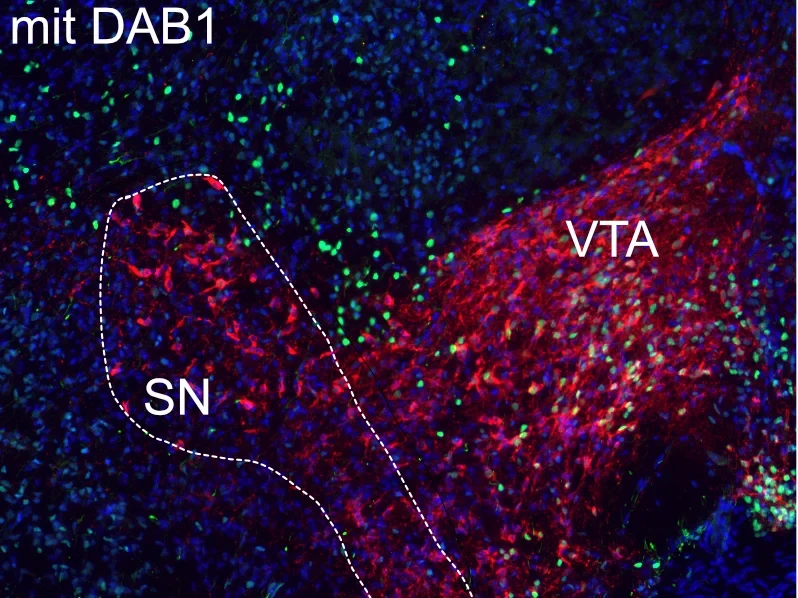
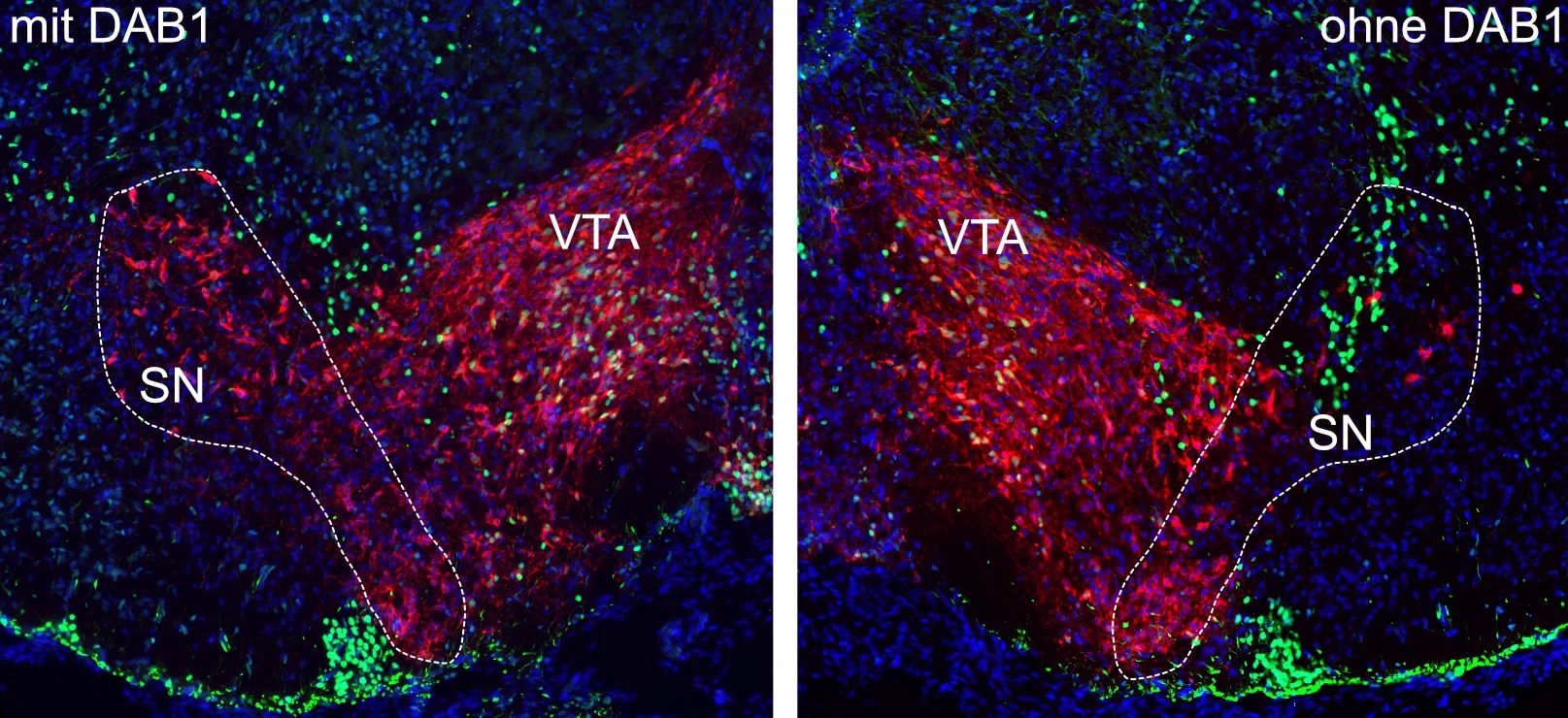
Die Wissenschaftler haben in ihrer Studie einen bestimmten Typ von Zellen untersucht, die dopaminergen Neurone des Mittelhirns. Ihren etwas sperrigen Namen verdanken sie ihrer Fähigkeit, den Botenstoff Dopamin zu produzieren. Dieser spielt bei der Signalübertragung zwischen bestimmten Nervenzellen eine wesentliche Rolle, etwa im sogenannten Belohnungssystem. Dieses sorgt dafür, dass wir bestimmte Erfahrungen als angenehm empfinden und danach streben, sie zu wiederholen. Eine verminderte Dopaminausschüttung aufgrund eines fortschreitenden Verlusts dopaminerger Neurone kann zudem zur Parkinson-Erkrankung mit ihren charakteristischen Defiziten bei Bewegungsabläufen führen.
Je nach Funktion findet man dopaminerge Neurone in verschiedenen Bereichen unseres Denkorgans. Einer davon ist die Substantia nigra, ein zweiter das ventrale Tegmentum. „Die dopaminergen Neurone von Substantia nigra und ventralem Tegmentum werden beide aus Vorläuferzellen im Mittelhirn gebildet“, erklärt Prof. Dr. Sandra Blaess vom Institut für Rekonstruktive Neurobiologie des Universitätsklinikums Bonn. „Während der Embryonalentwicklung wandern sie zunächst zusammen in eine Richtung und reifen dabei weiter heran.“
Reelin stabilisiert die Sprint-Form der Zellen
Dann jedoch endet der gemeinsame Marsch: Ein Teil der Zellen biegt Richtung Substantia nigra ab, der andere bleibt zurück, um das ventrale Tegmentum zu bilden. „Wir wussten, dass bei diesem Prozess ein Protein namens Reelin eine wichtige Rolle spielt“, erklärt Blaess' Mitarbeiterin Ankita Vaswani. „Welche genau, wollten wir in unserer Studie herausfinden.“
Dazu haben die Wissenschaftler in dopaminergen Neuronen in der Maus die Produktion des Proteins DAB1 unterbunden, das für die Übertragung des Reelin-Signals in die Zelle essenziell ist. Unter dem Mikroskop zeigte sich, dass es die Substantia Nigra-Neurone dann nicht mehr schaffen, ihre endgültige Position zu erreichen.
„Wir haben die Neurone nun mit einem fluoreszenten Protein markiert und dopaminerge Neurone mit und ohne DAB1 bei ihrer Wanderung gefilmt“, erklärt Vaswani. „Dabei stellten wir fest, dass sich die Zellen mit DAB1 in den meisten Phasen nur langsam bewegten, dazwischen aber rasche Sprints einlegten.“ Auffällig war, dass die „Sprinter“ stets Fortsätze aufwiesen, die eindeutig in Richtung der Wanderungsbewegung ausgerichtet waren, und dass diese Zellen besonders zielgerichtet wanderten. Unter den Neuronen ohne DAB1 waren dagegen weniger „Sprinter“ zu finden, ihre Zellform war weniger stabil und die Zellen verloren teilweise ihre Orientierung. „Reelin scheint die in Wanderungsrichtung orientierte Zellform zu stabilisieren und so dafür zu sorgen, dass die Zellen sich schneller und gezielter bewegen“, interpretiert Prof. Blaess die Ergebnisse.
Vor allem zeigen die Resultate aber, dass Reelin sehr direkt in die Zellwanderung eingreift. „Es handelt sich dabei jedoch nicht um einen Lockstoff, dem die dopaminergen Neurone folgen“, betont Sandra Blaess. „Stattdessen ist es vermutlich ein Faktor, der es den Neuronen ermöglicht, richtig auf andere Signale in ihrer Umgebung zu reagieren.“ Die Ergebnisse der Grundlagenstudie helfen den Wissenschaftlern, die komplexen Prozesse bei der Entstehung des Gehirns besser zu verstehen. Inwieweit sie sich auf das Gehirn des Menschen übertragen lassen, muss sich aber noch zeigen.
Publikation: Ankita R. Vaswani, Beatrice Weykopf, Cathleen Hagemann, Hans-Ulrich Fried, Oliver Brüstle und Sandra Blaess: Correct setup of the substantia nigra requires Reelin-mediated fast, laterally-directed migration of dopaminergic neurons; https://doi.org/10.7554/eLife.41623.0011
Kontakt:
Prof. Dr. Sandra Blaess
Heisenberg-Professur für Entwicklungsneurobiologie
Institut für Rekonstruktive Neurobiologie
Universitätsklinikum Bonn
Tel.: 0228/6885-540
E-Mail: sandra.blaess@uni-bonn.de