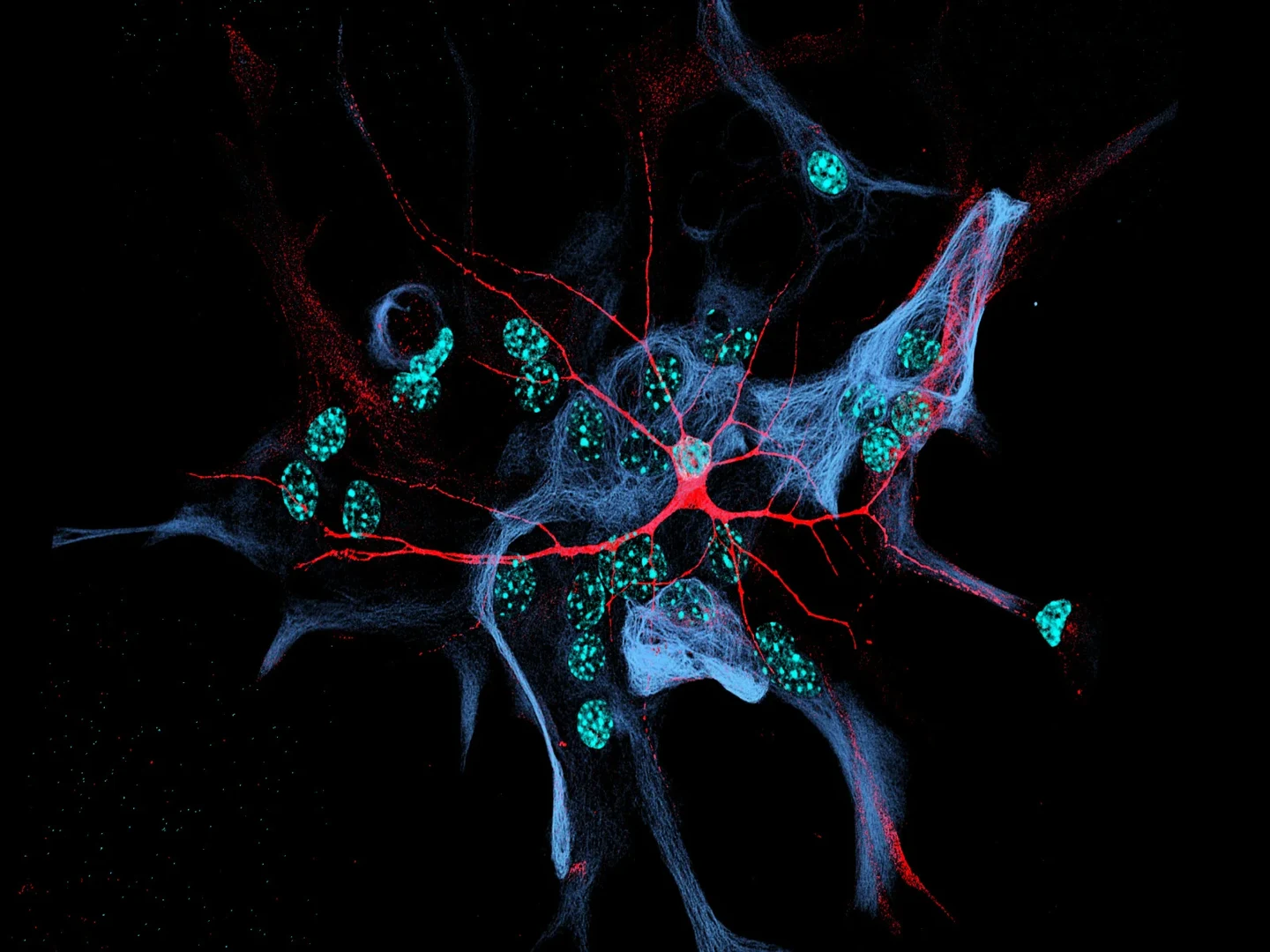
Mit dem Verfahren der Zellreprogrammierung lassen sich aus einer Blut- oder Hautprobe so genannte induziert pluripotente Stammzellen (iPS-Zellen) herstellen. Die Körperzellen werden in ein Embryonalstadium zurückversetzt und verfügen dann wieder über alle Möglichkeiten, sich in die unterschiedlichsten Zelltypen weiter zu differenzieren – von der Herzmuskel- bis hin zur Gehirnzelle. Deshalb sind die Erwartungen an diese Alleskönner groß. „Aus iPS-Zellen produzierte Nervenzellen sind heute das attraktivste Werkzeug für die Erforschung von Erkrankungen des Gehirns und für die Wirkstoffsuche“, sagt Prof. Dr. Oliver Brüstle vom Institut für Rekonstruktive Neurobiologie des Universitätsklinikums Bonn (UKB).
Allerdings sind solche aus iPS-Zellen gewonnene menschliche Nervenzellen sehr verschiedenartig. Je nachdem, welche Zellkulturmethode und welcher Gewinnungsweg gewählt wurden, reagieren sie in Experimenten sehr unterschiedlich. „Gewünscht ist jedoch ein Zellmodell, das bei Wiederholungen eines Experiments möglichst zu den gleichen Ergebnissen führt“, erläutert Dr. Michael Peitz aus Brüstles Team. Schließlich sollen die Resultate der Studien statistisch abgesichert sein.
Aus diesem Grund entwickelten und testeten die Wissenschaftler des UKB zusammen mit dem Max-Planck-Institut (MPI) für Experimentelle Medizin in Göttingen und der Vrije Universiteit Amsterdam ein Modell, das nur aus einer einzigen Nervenzelle besteht, die aus einer menschlichen iPS-Zelle gewonnen wurde. Dieser „Single“ sitzt auf Gliazellen, die sich auch im Gehirn in enger Nachbarschaft zu Nervenzellen befinden und diese in ihrer Funktion unterstützen.
Die Nervenzelle führt Selbstgespräche
Die Besonderheit: Die „Single“-Gehirnzelle führt Selbstgespräche, weil sämtliche Fortsätze (Axone), die normalerweise die Verbindung zu anderen Nervenzellen herstellen, zu ihr zurückführen. „Das Zellmodell ist praktisch kurzgeschlossen“, erklärt Dr. Kristina Rehbach, eine der Erstautorinnen der beiden Studien am Institut für Rekonstruktive Neurobiologie des UKB. Damit können die Wissenschaftler die „Single“-Nervenzelle belauschen, wie sie mit sich selbst plaudert.
Die kreisförmige Signalübertragung zwischen Axon und dem jeweiligen Neuron erfolgt über Synapsen. Dabei handelt es sich um Schnittstellen, an denen elektrische Signale eine Ausschüttung von Botenstoffen bewirken, die auf der Empfängerseite wieder zu elektrischen Impulsen führen. Hierbei können die Signale verstärkt oder auch abgeschwächt werden. Die Wissenschaftler des MPI in Göttingen und der Vrije Universiteit Amsterdam testeten, wie sich dieses Ein-Zell-Modell in Stimulationsexperimenten verhält. Sie verwendeten sowohl Zellen, die im Gehirn für die Erregung zuständig sind, als auch hemmende Nervenzellen. „Wir konnten zeigen, dass dieses nur aus einer Nervenzellen bestehende Modell in den Funktionstests in hohem Maße reproduzierbare Werte ergibt und damit eine sehr gute Grundlage für Hochdurchsatzexperimente darstellt“, sagt Prof. Dr. Matthijs Verhage von der Vrije Universiteit Amsterdam.
Vielfältige Anwendungsmöglichkeiten
Das Forscherteam sieht vielfältige Anwendungsmöglichkeiten für das „Single“-Nervenzellmodell. Damit lassen sich Krankheiten erforschen. „Ist zum Beispiel ein Protein an einer Synapse durch eine Genmutation verändert, sind die Folgen für die Signalübertragung direkt in diesem Modell beobachtbar“, sagt Prof. Brüstle. Ein weiterer Vorteil sei, dass sich über die iPS-Reprogrammierung auch direkt aus der Haut oder dem Blut Nervenzellen aus Patienten gewinnen und individuell untersuchen lassen. Über die Erforschung der verschiedensten Erkrankungen des Gehirns ist das Zellmodell damit auch für die Wirkstoffforschung interessant.
„Die hervorragende Zusammenarbeit der verschiedenen Forscherteams in diesem Projekt zeigt, dass die Kombination aus Stammzell-Technologie und funktioneller Untersuchung von Synapsen völlige neue Perspektiven eröffnet“, sagt Prof. Dr. Jeong Seop Rhee vom MPI für Experimentelle Medizin in Göttingen. Alle drei Forscherteams arbeiten in dem europäischen Verbundprojekt COSYN zusammen.
Publikationen:
A Single-Cell Model for Synaptic Transmission and Plasticity in Human iPSC-Derived Neurons, Cell Reports, DOI: 10.1016/j.celrep.2019.04.058
An Autaptic Culture System for Standardized Analyses of iPSC-Derived Human Neurons, Cell Reports, DOI: 10.1016/j.celrep.2019.04.059
Kontakt für die Medien:
Prof. Dr. Oliver Brüstle
Institut für Rekonstruktive Neurobiologie
Universitätsklinikum Bonn
Tel. +49 (0)228-6885 500
E-Mail: r.neuro@uni-bonn.de