Beim Stichwort „Körperfett“ denken viele an die Polster am Bauch oder an den Hüften. „Aber ohne die Lipide, wie diese Stoffe in der Chemie genannt werden, könnte kein Mensch überleben“, sagt Prof. Dr. Christoph Thiele vom LIMES-Institut der Universität Bonn. Denn Fette sind wichtige Energiespeicher. Ist zum Beispiel bei Krebserkrankungen der Fettstoffwechsel gestört, kommt es zum dramatischen Abmagern. Außerdem dienen die Lipide häufig als Bausteine für die Umhüllungen von lebenden Zellen, wie zum Beispiel Gehirnzellen. Darum können Störungen auch zu neurologischen Erkrankungen führen.
Wissenschaftler suchen deshalb nach Methoden, wie sie mit einer Art „Tracking“-Verfahren den Weg von der Aufnahme der Fette über den Stoffwechsel im Körper bis zur Ausscheidung verfolgen können – ähnlich einem auf der Post aufgegebenen Paket, dass sich bei der Zustellung auf seinem Weg zum Ziel mit Sendungsverfolgung orten lässt. Früher verwendeten Forscher hierfür radioaktive Substanzen, Fluoreszenz-Farbstoffe oder schwere Isotope von Wasserstoff-2 (Deuterium), mit denen die „Fett-Pakete“ markiert wurden.
„Das Problem liegt darin, dass die markierten Verbindungen nicht vollständig von den unmarkierten zu unterscheiden sind“, erläutert Thiele. Das führt dazu, dass sich nur einige wenige markierte Hauptverbindungen verfolgen lassen und dafür recht große Mengen an Substanz gebraucht werden.
Zerfallsreaktionen führen zu starken Signalen bei der Messung
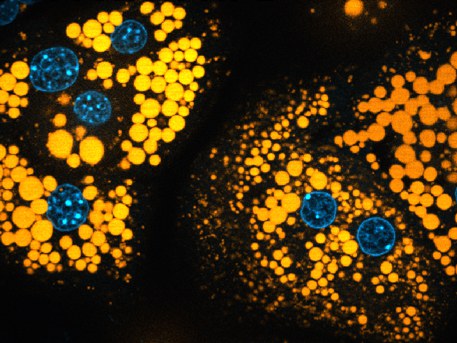
Der Biochemiker zeigte nun zusammen mit Klaus Wunderling und Philipp Leyendecker aus seinem Team, wie sich die Fette mit einer deutlich empfindlicheren und effektiveren Methode im Körper einer Maus verfolgen lassen. Sie setzten Leberzellen der Mäuse Fettsäuren zu, die mit einer zusätzlichen Dreifachbindung – einer sogenannten Alkingruppe – markiert waren. Daraufhin banden die Stoffwechselprodukte an spezielle sogenannte Reportermoleküle. In einem weiteren Schritt kollidierten die Verbindungen bei der Messung ihres Gewichtes im Massenspektrometer mit Gasmolekülen, wodurch sie in bestimmte Substanzen zerfielen, an denen erst die Markierung sichtbar wurde. „Diese Zerfallsreaktion produziert für die markierten Lipide sehr starke Signale im Massenspektrometer“, sagt Thiele. Damit lassen sich die markierten von den unmarkierten Lipiden deutlicher unterscheiden, und die Messungen sind rund 1000 Mal empfindlicher als mit herkömmlichen Methoden. Darüber hinaus geht es deutlich schneller: Statt nach Stunden liegt das Ergebnis bereits nach Minuten vor.
„Rund 100 verschiedene markierte Lipide lassen sich tatsächlich bis hinab in einzelne Leberzellen verfolgen“, berichtet der Biochemiker. Damit können sowohl der normale Stoffwechselweg, aber auch krankhafte Abweichungen davon, im Detail untersucht werden. Die Untersuchung von Leberzellen der Maus lag für die Wissenschaftler nahe, weil die Leber die „Haupt-Drehscheibe“ für den Fettstoffwechsel darstellt.
Für Ernährungsexperimente am Menschen sei es aber mit dieser Methode noch zu früh. „Es ist noch nicht bekannt, was die an Alkingruppen gekoppelten Fettsäuren im menschlichen Körper genau bewirken, wenn sie mit der Nahrung aufgenommen werden“, sagt Thiele. Allerdings ließen sich mit dieser Methode die Nebenwirkungen von Arzneistoffen auf den Fettstoffwechsel untersuchen und dadurch möglicherweise minimieren, ist der Wissenschaftler überzeugt. Da Verzehrexperimente am Menschen zunächst nicht möglich sind, könnte man die Nebenwirkungen an Zellkulturen oder Organoiden testen. Thiele: „Man kann dann sehr leicht sehen, wie der Lipidstoffwechsel durch die Wirkstoffe verändert wird.“
Publikation: Christoph Thiele, Klaus Wunderling, Philipp Leyendecker: Multiplexed and single cell tracing of lipid metabolism, Nature Methods, DOI: 10.1038/s41592-019-0593-6
Kontakt:
Prof. Dr. Christoph Thiele
Universität Bonn
Life & Medical Sciences Institute (LIMES)
Tel. 0228/7362818
E-Mail: cthiele@uni-bonn.de