Zellen können ihrem Leben selbst ein Ende setzen. Bei diesem Vorgang werfen sie sich bestimmten Immunzellen zum Fraß vor. Um deren Appetit zu wecken, produzieren sie auf ihrer Oberseite ein charakteristisches Selbstmord-Molekül. Diese Tatsache nutzten die Wissenschaftler für ihre Experimente: Sie nahmen ein Protein, das an diesen Selbstmord-Marker binden kann, und koppelten es mit einem Fluoreszenz-Farbstoff.
Wenn man Mausgewebe mit einem solchen fluoreszierenden Protein behandelt, leuchten die sterbenden Zellen unter einem Spezialmikroskop gelblich-grün auf. Auf diese Weise erhält man aber nur Standbilder. Der Ablauf der Apoptose (so die wissenschaftliche Bezeichnung für den geplanten oder programmierten Zelltod) im lebenden Tier lässt sich so nicht nachvollziehen.
„Wir haben daher Mäuse genetisch so verändert, dass sie das fluoreszierende Protein kontinuierlich selbst erzeugten“, erklärt Dr. Michael Hesse, Privatdozent am Institut für Physiologie I der Universität Bonn. „Auf diese Weise konnten wir beispielsweise filmen, wie die Apoptose an bestimmten Entwicklungs-Vorgängen im Embryo beteiligt ist.“ Denn bei der Entstehung von Herz, Wirbelsäule, Gehirn und anderen Organen im Mutterleib finden massive Umbauprozesse statt. Dabei spielt der programmierte Zelltod eine wesentliche Rolle. Wenn er nicht korrekt funktioniert, kann das drastische Folgen haben.
Methode macht Auflösung der „Schwimmhäute“ sichtbar
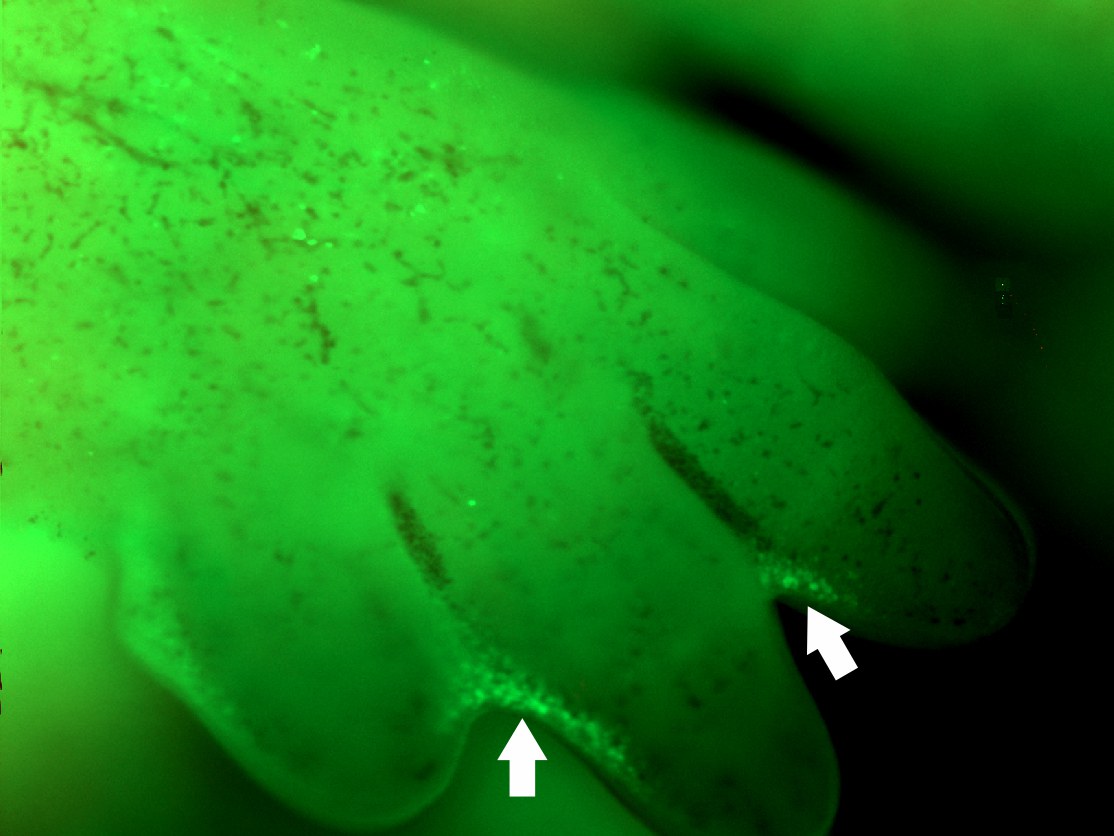
Die Studie liefert ein neues Werkzeug, das die Analyse solcher Vorgänge ermöglicht. Die Kooperationspartner aus Tokio nutzten es zum Beispiel, um den programmierten Zelltod bei der frühen Entwicklung der Wirbelsäule zu filmen (siehe auch die verlinkte Videosequenz). Auch die Auflösung der ursprünglich noch bei Mäuse-Embryonen vorhandenen „Schwimmhäute“ (Interdigitalfalten) konnten die Forscher auf diese Weise sichtbar machen.
„An unserem Institut interessieren wir uns vor allem für Entwicklungsstörungen beim Herzen sowie apoptotische Prozesse bei einem Infarkt“, erklärt Hesse. Die neue Methode erlaubt es, diese Fragestellungen mit relativ wenig Aufwand genauer zu untersuchen. Dazu planen die Wissenschaftler etwa, ihre Maus mit einem Stamm zu kreuzen, der bestimmte angeborene Herzfehler aufweist. „Auf diese Weise hoffen wir nachweisen zu können, ob und in welchem Ausmaß eine gestörte Apoptose dabei eine Rolle spielt.“
Publikation: Kristel Martínez-Lagunas, Yoshifumi Yamaguchi, Cora Becker, Caroline Geisen, Marco C. DeRuiter, Masayuki Miura, Bernd K. Fleischmann & Michael Hesse: In vivo detection of programmed cell death during mouse heart development; Cell Death & Differentiation; DOI: https://doi.org/10.1038/s41418-019-0426-21
Video: https://static-content.springer.com/esm/art%3A10.1038%2Fs41418-019-0426-2/MediaObjects/41418_2019_426_MOESM7_ESM.avi2
Das Video zeigt, wie sich während der Embryonalentwicklung das Neuralrohr schließt, aus dem später die Wirbelsäule entsteht. Die apoptotischen Zellen sind gelb bzw. grün markiert. © Yoshifumi Yamaguchi/Hokkaido University
Kontakt:
Privatdozent Dr. Michael Hesse
Institut für Physiologie I der Universität Bonn
Life & Brain Center
Tel. 0228/6885233
E-Mail: mhesse1@uni-bonn.de